
【题目】在400℃,1.01X105Pa时,将SO2和14molO2 压入一个装有催化剂的VL密闭反应器中,发生2SO2+O2![]() 2SO3的反应,并且在10min后达到平衡时,测得容器内有2molSO2和12molO2。
2SO3的反应,并且在10min后达到平衡时,测得容器内有2molSO2和12molO2。
(1)SO2的起始浓度为_______,SO3(气)的平衡浓度为_________;
(2)SO2的转化率为________,O2的平均反应速率为________;
(3)平衡时SO3(气)占总体积的百分数为__________,此时体系压强为反应起始时体系压强的________倍;
(4)达平衡后再加入2molSO2、12molO2和4molSO3(气),此时正反应速率将_______,逆反应速率将_______,平衡_______移动。
【答案】 6/Vmol·L-1 4 /Vmol·L-1 66.67% 0.2/Vmol·L-1·min-1 22.22% 0.9 增大 增大 正向
【解析】(1)由题干知O2的转化量是2mol,SO2的转化量是4mol,SO3的转化量是4mol。SO2的起始浓度为6/V mol·L-1,SO3(g)的平衡浓度为4/V mol·L-1;(2)SO2的转化率为![]() ×100%=66.67%。v(O2)=
×100%=66.67%。v(O2)= ![]() =0.2/V mol·L-1·min-1;(3)平衡时SO3占总体积的百分数为
=0.2/V mol·L-1·min-1;(3)平衡时SO3占总体积的百分数为![]() ×100%=22.22%。压强之比等于物质的量之比,
×100%=22.22%。压强之比等于物质的量之比, ![]() =0.9;(4)达平衡后再加入2molSO2、12molO2和4molSO3(g),相当于增大压强,正、逆反应速率均增大,平衡正向移动。
=0.9;(4)达平衡后再加入2molSO2、12molO2和4molSO3(g),相当于增大压强,正、逆反应速率均增大,平衡正向移动。


科目:高中化学 来源: 题型:
【题目】对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s) ΔH=-444.3 kJ·mol-1 ΔS=-280.1 J·mol-1·K-1。在常温、常压下反应能自发进行,对反应的方向起决定性作用的是( )
A. 熵变 B. 温度
C. 压强 D. 焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取气体的常见装置:
(1)仪器a的名称是;
(2)以A为发生装置,用高锰酸钾制取氧气,化学方程式为 , 试管口放一团棉花的作用是;
(3)以B为发生装置制取二氧化碳,加入药品之前要先检查装置的 , 收集二氧化碳通常选用(填标号);
(4)温度、浓度、固体的颗粒大小等因素会影响反应速率.为研究实验室制取二氧化碳的适宜条件,进行如
表四组实验:
实验编号 | 甲 | 乙 | 丙 | 丁 |
mg大理石 | 块状 | 块状 | 粉末状 | 粉末状 |
mg验算(过量) | 稀盐酸 | 浓盐酸 | 稀盐酸 | 浓盐酸 |
①大理石与盐酸反应的化学方程式是;
②实验甲与对照(填编号),是为了研究固体反应物颗粒大小对反应速率的影响;
③上述实验中,另一个影响反应速率的因素是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,其化学式为_________,具有_________气味,密度比空气的__________(填“大”或“小”),__________(填“易”或“难”)溶于水,因此,收集氨气应采用_______________法。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置完成以下实验: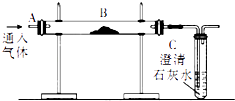
(1)探究燃烧条件:若B处盛放木炭.Ⅰ.先在A处通入氮气一段时间后,在B处加热,B、C处没有明显变化;
Ⅱ.待B处冷却至室温,在A处通入氧气一段时间后,B、C处没有明显变化;
Ⅲ.在A处继续通入氧气,然后在B处加热,发现木炭燃烧,C处变浑浊.
Ⅰ与Ⅲ对比,说明燃烧的条件之一是;
Ⅱ与Ⅲ对比,说明燃烧的条件之一是 .
(2)模拟工业炼铁:若B处盛处氧化铁粉末.在A处通入一氧化碳一段时间后,B处下方用喷灯加热,B处可观察到的现象为 , 写出该反应的化学方程式 . 尾气处理的方法为 .
(3)《自然》杂志刊载“绿色炼铁”技术;电解熔融的氧化铁得到铁和氧气,该反应的化学方程式 . 其基本反应类型为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 任何一个能层最多只有s、p、d、f四个能级
B. 用n表示能层序数,则每一能层最多容纳电子数为2n2
C. 核外电子运动的概率分布图(电子云)就是原子轨道
D. 电子的运动状态只可从能层、能级、轨道3个方面进行描述
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组同学为了测定实验室一瓶稀盐酸中溶质的质量分数.他们用铜锌合金和此稀盐酸完成了如图的实验.
(1)恰好反应时的实验现象是 .
(2)该瓶稀盐酸中溶质的质量分数?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝表面在空气中天然形成的氧化膜耐磨性和抗蚀性不够强。控制一定的条件,用如图所示的电化学氧化法,可在铝表面生成坚硬致密,耐腐蚀的氧化膜。下列有关叙述正确的是

A. 阴极上有金属铝生成
B. 电极A为石墨,电极B为金属铝
C. OH-在电极A上放电,有氧气生成
D. 阳极的电极反应式为:2Al-6e-+3H2O═AL2O3+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1 mL 1.00 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是( )
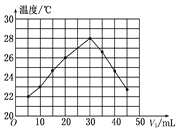
A. 做该实验时环境温度为22℃
B. NaOH溶液的浓度约为1.00 mol/L
C. 该实验表明有水生成的反应都是放热反应
D. 该实验表明化学能可以转化为热能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com