
| A. | 金属可能有氧化性 | B. | 金属具有导电性、导热性和延展性 | ||
| C. | 金属都能与盐酸反应 | D. | 金属都能与氧气反应 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积大小:③>②>① | B. | 原子数目:③>①>② | C. | 密度大小:②>③>① | D. | 质量大小:②>①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱 | B. | 食用醋 | C. | 氯化铵 | D. | 纯碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
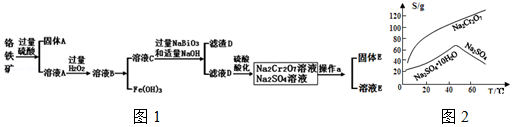
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提高CO2充气压力,饮料中c(A-)不变 | |
| B. | 当pH为5.0时,饮料中 $\frac{c(HA)}{c({A}^{-})}$=0.16 | |
| C. | 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低 | |
| D. | 结合H+的能力:A->HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
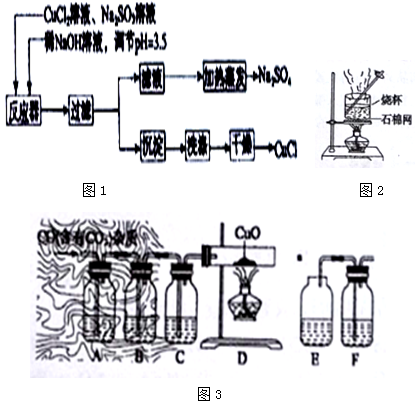
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
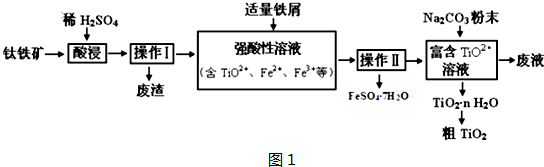
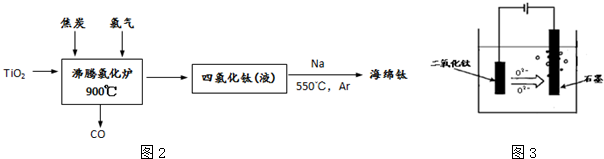
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com