
【题目】(1)①图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A数值为4,则量筒中液体的体积是①,由于放置位置不当读数时俯视,读出的数值为②则①②的正确数值为__________________
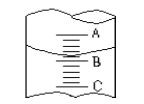
A①3.2mL、②小于3.2mL B.①4.8mL、②大于4.8mL
C.①3.2mL、②大于3.2ml D.①4.8mL、②小于4.8mL
②实验室需配制1mol·L-1的NaOH溶液220mL,在用托盘天平称取NaOH固体时,天平读数为________填代号,下同)。
A.大于8.8g B.小于8.8g C.8.8g
(2)表示溶液浓度的方法通常有两种;溶液中溶质的质量分数(W)和物质的量浓度 (c),因此在配制溶液时,根据不同的需要,有不同的配制方法。请完成下列填空题。
Ⅰ.用10%(密度为1.01g·cm3-)的氢氧化钠溶液配制成27.5g 2%的氢氧化钠溶液。
①计算:需_________g10%(密度为1.01g·cm3-)的氢氧化钠溶液
②量取:用量筒量取10%的氢氧化钠溶液_________mL
Ⅱ.把98%(密度为1.84g·cm3-)的浓硫酸稀释成2mol/L的稀硫酸100ml,回答下列问题:
①需要量取浓硫酸_______ mL
②下列实验操作使配制的溶液浓度偏低的是__________
A.容量瓶洗涤后未干燥
B.量取溶液时,仰视刻度线
C.装入试剂瓶时,有少量溶液溅出
D.没有洗涤烧杯和玻璃棒
E.定容时,加水不慎超出刻度线,又倒出一些
【答案】C A 5.5 5.4 10.9 D E
【解析】
(1) ①量筒的刻度从下往上增大,当刻度A数值为4时,则B为3,则液体的读数为3.2mL,若俯视读数,则数值变大,故选C。②实验室需配制1mol·L-1的NaOH溶液220mL,根据容量瓶的规格分析,应选择250mL的容量瓶,则氢氧化钠的固体质量为1×0.25×40=10.0g,故选A。(2) Ⅰ①根据溶质的质量不变原则,假设溶液的质量为xg,则有x×10%=27.5×2%, 解x=5.5g。②溶液的体积为5.5/1.01=5.4mL。 Ⅱ. ①假设硫酸的体积为xL,则根据溶质不变分析,有98%×1.84×1000x=2×0.1×98,解x=0.0109L=10.9mL。②A.容量瓶洗涤后未干燥,不影响,故错误;B.量取溶液时,仰视刻度线,则溶质的物质的量增加,故浓度变大,故错误;C.装入试剂瓶时,有少量溶液溅出,溶液的浓度不变,故错误;D.没有洗涤烧杯和玻璃棒,溶质有损失,故浓度变小,故正确;E.定容时,加水不慎超出刻度线,又倒出一些,倒出部分溶质,浓度变小,故正确。故选DE。


科目:高中化学 来源: 题型:
【题目】下列四种酸与锌片反应,起始时生成H2反应速率最大的是
A. 10 ℃ 20 mL 3 mol/L的盐酸 B. 10 ℃ 40 mL 2 mol/L的醋酸
C. 20 ℃ 20 mL 2 mol/L的硫酸 D. 20 ℃ 10 mL 4 mol/L的硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是硫酸试剂瓶标签上的内容:
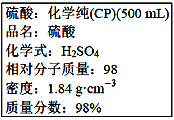
(1)该硫酸的物质的量浓度是____________________ molL-1。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240mL4.6 molL-1的稀硫酸,则需要取________mL的该硫酸来进行配制实验。
(3)将上述硫酸进行稀释的实验操作为________________________。
(4)用上述硫酸配制240mL4.6 molL-1的稀硫酸,实验仪器有:①50mL量筒 ②100mL量筒 ③托盘天平 ④玻璃棒 ⑤250mL容量瓶 ⑥胶头滴管 ⑦烧杯 ⑧锥形瓶,实验时使用选用仪器的先后顺序为__________。
(5)下列操作会使配制的溶液浓度偏高的是_________________(填下列选项的编号字母)。
A.没有将洗涤液转移到容量瓶 B.转移过程中有少量溶液溅出
C.摇匀后,液面下降,补充水 D.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。回答下列问题:
(1)钒在元素周期表中的位置为_______,其价层电子排布图为____________。
(2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为____、_____。
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是__对,分子的立体构型为___;SO3气态为单分子,该分子中S原子的杂化轨道类型为____;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为___;该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为__(填图2中字母),该分子中含有___个σ键。

(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为___;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按官能团的不同,可以对有机物进行分类,请指出下列有机物的种类,填在横线上。
① CH3CH=CHCH 3 __________;
② ![]() ___________;
___________;
③ ![]() __________;
__________;
④ ![]() _____________;
_____________;
(2)按系统命名法命名
①CH3 CH(C2H5)CH(CH3)2 的名称___________________
②(CH3)2C=C(CH3)2 的名称______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述中正确的是( )
A. 常温下,![]() 的
的![]() 与
与![]() 混合溶液中:
混合溶液中:![]()
B. NaCl溶液和![]() 溶液均显中性,两溶液中水的电离程度相同
溶液均显中性,两溶液中水的电离程度相同
C. 已知![]() 时
时![]() 溶液显碱性,则
溶液显碱性,则![]() 时的电离平衡常数
时的电离平衡常数![]()
D. ![]() 醋酸溶液加少量水稀释
醋酸溶液加少量水稀释![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于乙酸的下列叙述中错误的是( )
A.乙酸是有刺激性气味的液体,是食醋的主要成分
B.乙酸具有酸的通性,可以使石蕊等指示剂变色
C.乙酸在常温下可以发生酯化反应
D.乙酸可以和NaHCO3溶液反应放出CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的量的计算是中学化学的重要部分,请回答下列有关物质的量的计算问题。
(1)在标准状况下,67.2 L CO2是__________mol,质量为_______g,含有__________个CO2分子,其中含有__________mol氧原子。
(2)在标准状况下,1.7 g氨气所占的体积约为_________L,它与同条件下_____mol H2S含有相同的氢原子数。
(3)某气态氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积是448 mL,则氧化物的摩尔质量为_______,R的相对原子质量为__________。
(4)实验室常用浓硫酸的质量分数为98%,密度为1.80 g·mL1,其物质的量浓度是_______。
(5)标准状况下,将V L A气体(摩尔质量为M g/mol)完全溶于0.1 L水(密度1 g/cm3)中,所得溶液的密度为d g/mL,则此溶液的物质的量浓度为_______mol/L。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素单质在碱性溶液中容易发生歧化反应,歧化的产物依反应温度的不同而不同。
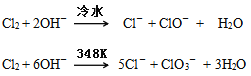
下图为制取氯气、氯酸钾、次氯酸钠和检验氯气性质的微型实验装置:

装置中盛装的药品如下:①多用滴管中装有5mL浓盐酸;②微型支管试管中装有1.5gKMnO4;③微型支管试管中装有2~3mL浓硫酸;④U形反应管中装有30%KOH溶液;⑤U形反应管中装有2mol/LNaOH溶液;⑥、⑦双U形反应管中分别装有0.1mol/LKI-淀粉溶液和KBr溶液;⑧尾气出口用浸有0.5mol/LNa2S2O3溶液的棉花轻轻覆盖住

(1)整套装置气密性检查的方法_________________________。
(2)为了使装置④、⑤中的反应顺利完成,应该控制的反应条件分别为________________________________。
(3)装置⑥、⑦中能够观察到的实验现象分别是____________________。
(4)如果把装置⑥、⑦中的试剂互换位置,还能否证明氧化性:Cl2>I2,______(填“能”或“不能”),理由是:______________。
(5)已知氯酸钾和氯化钾的溶解度曲线如下图所示,反应结束后,从装置④中提取氯酸钾晶体的实验操作是_____________。
(6)尾气处理时发生反应的离子方程式为____________________。
(7)选择微型实验装置的优点有___________________(至少写两点)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com