
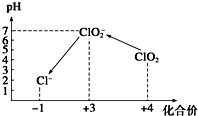
 ClO2气体是一种常用的消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种常用的消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.分析 (1)ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,Fe、Mn元素的化合价升高,则Cl元素的化合价降低;
(2)Cl元素的化合价由+5价降低为+4价,则S元素的化合价升高,结合电子守恒及原子守恒分析;
(3)①操作I中发生ClO2、I-的氧化还原反应;
②加入一定量的Na2S2O3溶液,由2S2O32-+I2═S4O62-+2I-可知,完全反应时不存在单质碘;
③酸性溶液中发生氧化还原反应生成碘单质,ClO2-表现氧化性被还原为氯离子;
④根据关系式ClO2~I-~S2O32-先计算出ClO2的物质的量,然后再计算出浓度.
解答 解:(1)ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,Fe、Mn元素的化合价升高,则Cl元素的化合价降低,可说明ClO2具有氧化性,
故答案为:氧化;
(2)Cl元素的化合价由+5价降低为+4价,则S元素的化合价升高,结合电子守恒及原子守恒可知还生成K2SO4,故答案为:K2SO4;
(3)①操作I中发生ClO2、I-的氧化还原反应,其离子反应为2ClO2+2I-═2ClO2-+I2,加入淀粉溶液,溶液变蓝,故答案为:2ClO2+2I-═2ClO2-+I2;
②加入一定量的Na2S2O3溶液,由2S2O32-+I2═S4O62-+2I-可知,完全反应时不存在单质碘,则操作Ⅱ完全反应的现象是蓝色消失,半分钟内不变色,
故答案为:蓝色消失,半分钟内不变色;
③酸性溶液中发生氧化还原反应生成碘单质,离子反应为ClO2-+4I-+4H+=Cl-+2I2+2H2O,
故答案为:ClO2-+4I-+4H+=Cl-+2I2+2H2O;
④操作Ⅱ时消耗了1.0×10-3 mol•L-1的Na2S2O3溶液10mL,其物质的量为1.0×10-3 mol/L×0.01L,
ClO2 ~I-~S2O32-
1 1
1.0×10-5mol 1.0×10-3 mol/L×0.01L
m(ClO2)=n(ClO2)×M(ClO2)=1.0×10-5mol×67.5×103mg•mol-1=0.675mg,
由于水样的体积为1.0L,所以 ClO2 的浓度为$\frac{0.675mg}{1L}$=0.675 mg•L-1,
故答案为:0.675.
点评 本题考查物质含量的测定实验,为高频考点,把握发生的氧化还原反应、关系式法的计算为解答的关键,侧重分析与计算能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
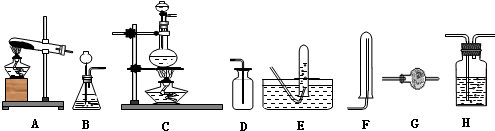
| 制取气体 | 杂质气体 | 制取气体的发生装置 | 除去杂质气体的净化装置 | 收集装置 | 净化装置内 所用试剂 | 检验制得气体所用试剂 |
| NH3 | H2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 3:1 | C. | 1:1 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
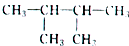 的系统命名为2,3-二甲基丁烷;
的系统命名为2,3-二甲基丁烷;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、过滤、蒸馏 | B. | 过滤、蒸馏、分液 | C. | 分液、蒸馏、过滤 | D. | 蒸馏、过滤、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com