
 �״�����Ϊȼ�ϵ�ص�ԭ�ϣ���CH4��H2OΪԭ�ϣ�ͨ�����з�Ӧ���Ʊ��״���
�״�����Ϊȼ�ϵ�ص�ԭ�ϣ���CH4��H2OΪԭ�ϣ�ͨ�����з�Ӧ���Ʊ��״������� ��1�����ݸ�˹���ɽ���֪�Ȼ�ѧ����ʽ����������
��2��������ʽ��ʾ��������ʼ����ת������ƽ���������ݷ�Ӧ���ʼ��㹫ʽV=$\frac{��C}{��t}$������
��3����������������Ӧ���״��ڸ���ʧȥ���ӣ���������������̼�����ˮ��
��4����ͨ���Co2+������Co3+������������ʧ���ӷ���������Ӧ���缫��ӦΪCo2+-e-=Co3+��
����Co3+����������ˮ�еļ״�������CO2����������������ԭΪCo2+��ԭ���غ������غ��֪����ԭ����H+����ƽ��дΪ��6Co3++CH3OH+H2O=CO2��+6Co2++6H+��
��� �⣺��1����CH4��g��+H2O��g���TCO��g��+3H2��g����H=+206.0kJ•mol-1
��CO��g��+2H2��g���TCH3OH��g����H=-129.0kJ•mol-1
���ݸ�˹���ɣ���-��ã�CH4��g��+H2O��g��=CH3OH��g��+H2��g����H=+206.0kJ/mol-��-129.0kJ/mol��=+77.0 kJ/mol��
�ʴ�Ϊ��CH4��g��+H2O��g��=CH3OH��g��+H2��g����H=+77.0 kJ/mol��
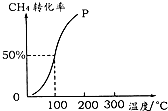
��2����1.0mol CH4��2.0mol H2O �� g ��ͨ���ݻ��̶�Ϊ100L�ķ�Ӧ�ң���һ�������·�����ӦI����ͼ���֪100�����ת����Ϊ50%���ʲμӷ�Ӧ�ļ���Ϊ1mol��50%=0.5mol����
CH4 ��g��+H2O ��g��=CO ��g��+3H2 ��g��
��ʼ����mol����1.0 2.0 0 0
�仯����mol����0.5 0.5 0.5 1.5
ƽ������mol����0.5 1.5 0.5 1.5
����100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ�÷�Ӧ��ƽ�ⷴӦ����V��H2��=$\frac{\frac{1.5mol}{100L}}{15min}$=0.001 mol•L-1•min-1��
�ʴ�Ϊ��0.001 mol•L-1•min-1��
��3����������������Ӧ���״��ڸ���ʧȥ���ӣ���������������̼�����ˮ�������缫��ӦʽΪ��CH3OH-6e-+8OH-�TCO32-+6H2O���ʴ�Ϊ��CH3OH-6e-+8OH-�TCO32-+6H2O��
��4����ͨ���Co2+������Co3+������������ʧ���ӷ���������Ӧ���缫��ӦΪCo2+-e-=Co3+���ʴ�Ϊ��Co2+-e-=Co3+��
����Co3+����������ˮ�еļ״�������CO2����������������ԭΪCo2+�����ԭ���غ������غ��֪����ԭ����H+����ƽ��д���ӷ���ʽΪ��6Co3++CH3OH+H2O=CO2��+6Co2++6H+��
�ʴ�Ϊ��6Co3++CH3OH+H2O=CO2��+6Co2++6H+��
���� ���⿼���Ȼ�ѧ����ʽ��д����ѧƽ��ͼ��Ӱ�컯ѧƽ�����ء�ƽ�ⳣ���뷴Ӧ���ʼ��㡢ԭ��صȣ����ջ����ǽⱾ��Ĺؼ�����Ŀ�Ѷ��еȣ�


 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
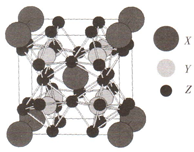 ij����ʵ���ȵ�ЧӦ�ľ���ľ���ģ������ͼ����֪�������������ԭ������ͬ��Yԭ��λ��Zԭ��Χ�ɵİ��������ģ�����˵����ȷ���ǣ�������
ij����ʵ���ȵ�ЧӦ�ľ���ľ���ģ������ͼ����֪�������������ԭ������ͬ��Yԭ��λ��Zԭ��Χ�ɵİ��������ģ�����˵����ȷ���ǣ�������| A�� | ����X�����Yԭ����8�� | B�� | ����X�����Xԭ����6�� | ||
| C�� | ����X�����Zԭ����3�� | D�� | �þ���Ļ�ѧʽΪX2Y8Z12 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH=0����Һ�У�Fe2+��NO3-��SO42-��Na+ | |
| B�� | c��H+��=1��10-14mol•L-1����Һ�У�Mg2+��NO3-��Fe2+��ClO- | |
| C�� | ���д���Fe3+����Һ�У�Na+��I-��K+��NO3- | |
| D�� | ��ˮ�������c��OH-��=1��10-13mol/L����Һ�У�Na+��[Al��OH��4]-��S2-��CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ߵ��������1 | B�� | �������������1 | C�� | �������������1 | D�� | ����Ϊͬλ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
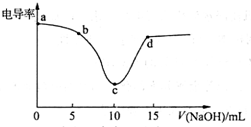 ���õ絼�ʴ������ɻ��Ƶ絼������ͼ����ͼΪ��0.1mol•L-1NaOH��Һ�ζ�10mL��0.1mol•L-1��������еĵ絼�����ߣ�����˵��������ǣ�������
���õ絼�ʴ������ɻ��Ƶ絼������ͼ����ͼΪ��0.1mol•L-1NaOH��Һ�ζ�10mL��0.1mol•L-1��������еĵ絼�����ߣ�����˵��������ǣ�������| A�� | �絼�ʴ������������ж�����к͵ζ����յ� | |
| B�� | �ù����У�a����ʾ��Һ�ĵ�������ǿ | |
| C�� | c��絼����С����Ϊ��ʱ��Һ�е���������Ŀ���� | |
| D�� | d����ʾ��Һ�д��ڣ�c��Cl-��+c��OH-��=c��H+��+c��Na+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ǿ���Ե���Һ�У�Na+��Ba2+��Cl-��NO3- | |
| B�� | ��ʹ��ɫʯ����Һ��������Һ�У�Ca2+��Fe2+��AlO2-��Cl- | |
| C�� | ������Ӧ������ɫ����ζ�������Һ�У�Na+��K+��HCO3-��SO42- | |
| D�� | �ں�����Fe3+����Һ�У�NH4+��Na+��Cl-��SCN- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 4��5��2 | B�� | 2��5��4 | C�� | 1��3��2 | D�� | 3��2��1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com