
许多金属及它们的化合物在科学研究和工业生产中具有许多用途.回答下列有关问题:
(1)基态Ni核外电子排布式为________________, 第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是________________;
(2) 已知CrO5中Cr为+6价,则CrO5的结构式为 。
已知CrO5中Cr为+6价,则CrO5的结构式为 。
 金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n ,与Ni(CO)n中配体
金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n ,与Ni(CO)n中配体
互为等电子体的离子的化学式为 (写出一个即可)。
 铜是第四周期最重要的过渡元素之一,其单质及化合物有广泛用途。已知CuH晶
铜是第四周期最重要的过渡元素之一,其单质及化合物有广泛用途。已知CuH晶
体结构单元如图所示。该化合物的的密度为ρg/cm3,阿伏加德罗常数的值为NA,则
该晶胞中Cu原子与H原子之间的最短距离为 cm(用含ρ和NA的式子表示)。

(3)另一种铜金合金晶体具有面心立方最密堆积的结构,在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为__________,若该晶胞的边长为a pm,则合金的密度为_________ g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)
【知识点】物质结构、核外电子排布、等电子体、晶胞计算
【答案解析】(1)1S22S22P63S23P63d84s2 C ( 2 ) 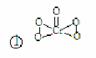
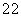 CN-
CN-
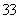
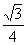
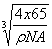 (3)1:3
(3)1:3 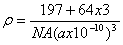
解析:(1)Ni的原子序数为28,根据能量最低原理可写出电子排布式为1S22S22P63S23P63d84s2
第二周期有2个未成对电子的元素是C和O元素,电负性较小的是C元素。
(2) CrO5中Cr为+6价形成6个键,则只能如图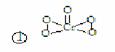
 CO的等电子体的离子的化学式为CN-
CO的等电子体的离子的化学式为CN- 通过计算法则每个CuH晶胞结构含4个铜原子4个氢原子,晶胞的棱长为
通过计算法则每个CuH晶胞结构含4个铜原子4个氢原子,晶胞的棱长为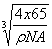 铜氢原子间的最短距离为体对角线长的1/4即
铜氢原子间的最短距离为体对角线长的1/4即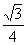
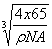
(3) 在晶胞中Cu原子处于面心,N(Cu)=6×1/2=3,Au原子处于顶点位置,N(Au)=8×1/8=1,则该合金中Au原子与Cu原子数量之比为1:3。该晶胞的边长为a pm(1pm=10-10cm),则合金的密度为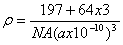 。
。
【思路点拨】本题主要考查物质结构,主要有核外电子排布、等电子体等基础知识,还有晶胞、分子结构的简单计算,难度不大。


科目:高中化学 来源: 题型:
A~X七种有机物间转化关系如图所示。其中气体A在标准状况下密度为1.25 g/L,且碳元素的质量分数为85.7%;E普遍存在于许多食物中(如花生、菠菜等);F分子中含有一个六元环,晶体X中仅含C、H、O三种元素,且原子个数比为1:3:3。试回答下列问题:
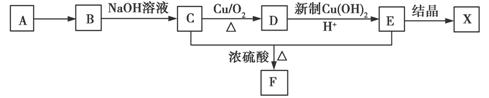
(1)C的结构简式为______________;晶体X的化学式为________________________。
(2)下列转化过程涉及的有机化学反应中,属于取代反应的是________(填序号)。
①A→B ②B→C ③C→D ④D→E ⑤C、E→F
(3)写出D与新制Cu(OH)2悬浊液反应的方程式:_____________________________;
写出C与E生成高分子化合物的化学方程式:____________________________。
(4)简述确定有机物B中官能团的实验方法:________________________________________
_____________________________________________________________________________。
(5)有机物W是F的同系物,具有和F相似的结构,分子组成比F多四个碳原子,也含有六元环,其1H-NMR谱图上只有一个峰,写出一种符合上述条件的W的结构简式:______________________。
(6)有机物Y是一种重要有机化工原料,可制备调香剂、皮肤创伤的愈合剂和某些药品(如头孢)等,Y的分子组成比E少一个氧原子,Y有两种不同的含氧官能团。通过电解方法可由E制取Y,电解槽中阳极通常用石墨,阴极用复合膜电极,采用阳离子交换膜,电解质溶液为饱和E与H2SO4的混合溶液。写出电解槽中阴极的电极反应式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向10.4g Fe3O4、Fe2O3、Cu的混合物中加入1 mol·L−1的硫酸溶液140mL时,固体恰好完全溶解,所得溶液中不含Fe3+,若用过量的H2在高温下还原相同质量的原混合物,固体减少的质量为( )
A.1.12g B.2.24g C.3.24g D.6.42g
查看答案和解析>>
科目:高中化学 来源: 题型:
从下列事实,找出不能用勒沙特列原理解释的是
A.在溴水中存在如下平衡: ,当加入NaOH溶液后颜色变浅
,当加入NaOH溶液后颜色变浅
B.对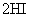

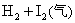 平衡体系增加压强使颜色变深
平衡体系增加压强使颜色变深
C.反应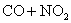

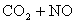 升高温度使平衡向逆方向移动
升高温度使平衡向逆方向移动
D.合成氨反应: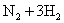

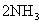 ,为使氨的产率提高,理论上应采取低温高压的措施
,为使氨的产率提高,理论上应采取低温高压的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,分别对反应C(s)+CO2(g) 2CO(g)(正向吸热)进行如下操作(只改变该条件):①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应速率显著变大的是 ( )
2CO(g)(正向吸热)进行如下操作(只改变该条件):①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应速率显著变大的是 ( )
A.①②③④ B.①③④ C.①② D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
有关化学用语正确的是 ( )
A.乙烯的结构简式CH2CH2 B.乙醇的结构简式C2H6O
C.四氯化碳的结构式CCl4 D.乙酸的分子式C2H4O2
查看答案和解析>>
科目:高中化学 来源: 题型:
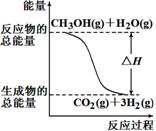
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是( )
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH =+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
根据上述反应,下列说法正确的是
A. 反应①中的能量变化如右图所示
B. 可推知2H2(g)+O2(g)=2H2O(g)
ΔH=-483.8 kJ/mol
C. 1 mol CH3OH充分燃烧放出的热量为192.9 kJ
D. CH3OH转变成H2的过程一定要吸收能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com