
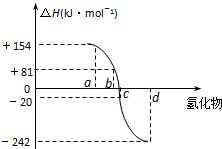
 已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H).如图为氧族元素氢化物a、b、c、d的生成热数据示意图.试回答下列问题:
已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H).如图为氧族元素氢化物a、b、c、d的生成热数据示意图.试回答下列问题: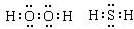 ,
,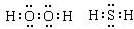 ;
;

科目:高中化学 来源: 题型:
| A、Si可用于制造半导体材料 |
| B、氧化镁、氧化铝可用作耐火材料 |
| C、福尔马林溶液可用作浸泡海产品,进行保鲜 |
| D、过氧化钠可用作呼吸面具中氧气的来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L0.1mol?L-1的碳酸钠溶液中碳酸根离子数目为0.1NA |
| B、以硫酸铝和小苏打为主要反应物的泡沫灭火器中的反应原理:Al3++3HCO3-═Al(OH)3↓+3CO2↑ |
| C、0.1mol/LFeCl3溶液中,含有K+、Na+、HCO3-、SO42-,这些离子一定大量共存 |
| D、T℃时,pH=6的纯水中,含10-6NA个OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由上述反应可知,受热时C4H10比C4H6更难分解 |
| B、1,3-丁二烯比2-丁炔稳定 |
| C、1,3-丁二烯转化为2-丁炔要吸收热量 |
| D、1mol 1,3-丁二烯气体比1mol 2-丁炔气体储存的能量低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心 |
| B、H2O的熔、沸点大于H2S是由于H2O分子之间存在氢键 |
| C、乙醇分子与水分子之间只存在范德华力 |
| D、氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com