
分析 Na2CO3水解生成的NaHCO3和NaOH,由于生成的NaOH不具有挥发性,NaOH与NaHCO3反应生成Na2CO3,故蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到Na2CO3•10H2O固体.
解答 解:Na2CO3在溶液中水解生成NaHCO3和NaOH,水解方程式为:Na2CO3+H2O?NaOH+NaHCO3,由于生成的NaOH不挥发,NaOH与NaHCO3反应生成Na2CO3,所以将Na2CO3溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到Na2CO3•10H2O固体,故答案为:对.
点评 本题考查了盐的水解原理及其应用,题目难度不大,注意掌握盐的水解原理及其应用方法,试题有利于培养学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 醋酸钠 | B. | 硝酸钾 | C. | 硫酸铵 | D. | 硫酸铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “类钫”在化合物中呈+1价 | |
| B. | 类钫具有放射性 | |
| C. | 单质与水反应较为缓慢 | |
| D. | 类钫最高价氧化物对应的水化物是强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2 | B. | MgCl2 | C. | KCl | D. | FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气的电子式: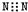 | B. | 硫原子的结构示意图: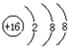 | ||
| C. | 溴化钠的电子式: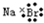 | D. | 质量数为37的氯原子${\;}_{17}^{37}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可使溴水溶液褪色 | B. | 不能与酸性高锰酸钾溶液反应 | ||
| C. | 能发生银镜反应 | D. | 一定条件下能发生加聚反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com