
下列各组顺序的排列不正确的是( )
A.原子半径:Na > Mg > Al > H B.热稳定性: HCl < H2S < PH3
C.酸性强弱:H2SiO3 < H2CO3 < H3PO4 D.氧化性:K+ < Na+ < Mg2+ < Al3+
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:选择题
下列各图与表述不一致的是
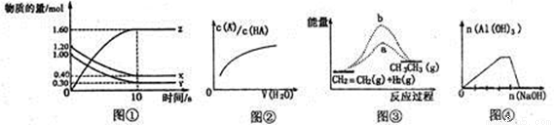
A. 图①表示T℃时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线。若T℃时,若起始时X为1.20mol,Y为1.00mol,则平衡时Y的转化率为80%
B. 图②中曲线表示向弱酸HA的稀溶液中加水稀释
C. 图③b曲线表示反应CH2=CH2(g)+H2(g)→CH3-CH3(g) △H<0,使用催化剂时,反应过程中的能量变化
D. 图④表示向NH4Al(SO4)2溶液中滴加过量的NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合3 题型:简答题
某课外活动小组同学用如图装置进行实验,试回答下列问题。
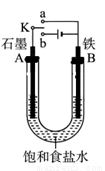
(1)若开始时开关K与b连接,则B极的电极反应式为 ,总反应的离子方程式为 ,有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(2)上述实验反应一小段时间后,再把开关K与a连接,则B极的电极反应式为 。
(3)该小组同学认为如果模拟工业上离子交换膜法制烧碱的方法,则可以设想用如下图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
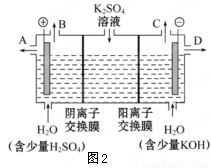
①该电解槽的阳极反应式为 。此时通过阴离子交换膜的离子数 (填”大于”或”小于”或”等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口 (填写“A”、“B”、“C”、“D”)导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 。
⑤燃料电池所用燃料可以是氢气,也可以是其他燃料,如甲醇、肼等。液态肼(分子式N2H4)可以在氟气中燃烧生成氮气和氟化氢。利用肼、氟气与KOH溶液组成碱性燃料电池,请写出该电池负极的电极反应式? ? 。
查看答案和解析>>
科目:高中化学 来源:2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(解析版) 题型:选择题
1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合溶液中加入足量的铜粉,从离子反应的角度分析,则最多能溶解铜粉的质量为( )
A.9.6g B.6.4 g C.3.2 g D.2.4 g
查看答案和解析>>
科目:高中化学 来源:2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(解析版) 题型:选择题
核电荷数小于l8的某元素X,其原子的电子层数为n,最外层电子数为(2n+1),
原子核内质子数为(2n2一1)。下列关于元素X的说法中,不正确的是( )
A.其最高化合价一定为+5 B.可以形成化学式为KXO3的盐
C.其氢化物可以用来做喷泉实验 D.其最高价氧化物的水化物是强酸
查看答案和解析>>
科目:高中化学 来源:2014江苏常熟市高二化学期末模拟4(必修2、选修4、结构)试卷(解析版) 题型:实验题
(10分)某研究小组为了研究不同条件下金属铝粉在过量稀硫酸中的溶解性能,设计如下实验。已知:c(H2SO4)=4.5 mol·L-1,反应均需要搅拌60min。
编号 | 温度/℃ | 加入某盐 | H2SO4体积/mL | H2O体积/mL | 铝粉加入量/g | 铝粉溶解量 /g |
① | 20 | 不加 | 40 | 0 | 2.0050 | 0.0307 |
② | 80 | 不加 | 40 | 0 | 2.0050 | 0.1184 |
③ | t1 | 不加 | 20 | V1 | 2.0050 | ﹨ |
④ | t2 | 5 mL0.01 mol·L-1 CuSO4溶液 | 20 | V2 | 2.0050 | ﹨ |
(1)实验①和②的目的是 。
为了获得铝粉溶解量,还需要测量的数据是 。
(2)实验①和③是为了研究硫酸的浓度对该反应的影响,则t1= ℃,V1= mL。
(3)实验③和④是为了研究加入CuSO4溶液对该反应的影响,则t2= ℃,V2= mL。
研究表明,在相同条件下加入少量CuSO4有利于Al的溶解。原因是 。
查看答案和解析>>
科目:高中化学 来源:2014江苏常熟市高二化学期末模拟4(必修2、选修4、结构)试卷(解析版) 题型:选择题
对于常温下pH=2的盐酸和pH=3的醋酸,下列说法正确的是
A.pH=2的盐酸中:c(H+)=c(Cl-) + c(OH-)
B.pH=3的醋酸中:c(H+)=3.0 mol·L-1
C.pH=2的盐酸与pH=3的醋酸中溶质的物质的量浓度之比为10:1
D.pH=3的醋酸与pH=11的NaOH溶液等体积混合所得溶液中:c(Na+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版4.3铜及其化合物 金属材料与复合材料练习卷(解析版) 题型:填空题
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
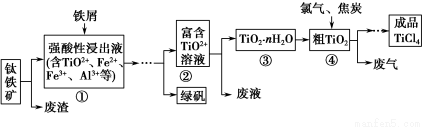
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在 范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+??Fe3++3H2O的平衡常数K= 。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式: 。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用 方法。
| TiCl4 | SiCl4 |
熔点/℃ | -25.0 | -68.8 |
沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版3.3硫的转化练习卷(解析版) 题型:选择题
如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )。

A.蓝色石蕊试纸先变红后退色
B.品红试纸、沾有酸性KMnO4溶液的滤纸均退色,证明SO2具有漂白性
C.湿润淀粉?KI试纸未变蓝说明SO2的氧化性弱于I2
D.NaCl溶液可用于除去实验中多余的SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com