
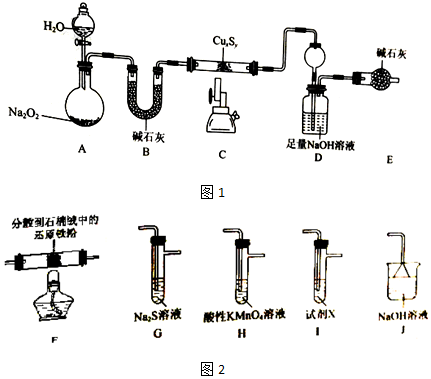
分析 I、A中生成氧气,B干燥生成的氧气,在C中CuxSy与氧气高温灼烧,D吸收灼烧生成的二氧化硫气体,E吸收空气中的二氧化碳,防止干扰二氧化硫的吸收,
(1)根据仪器构造可知;
(2)连续通入氧气的目的是赶走二氧化硫充分在D中吸收;
(3)沉淀为硫酸钡,23.3g,根据硫元素守恒可得硫元素的质量,则16.0gCuxSy的铜元素的质量可得,据此计算;
(4)若无装置E,测得的硫元素质量偏大,则x:y偏小;
II、(5)选用实验I中的装置A、B、C和图2所示装置,依次验证SO2的漂白性,氧化性和还原性,其中漂白性由品红溶液检验,氧化性用硫化钠检验,还原性由酸性高锰酸钾检验,最后用氢氧化钠吸收尾气二氧化硫;
(6)试剂X为品红溶液,二氧化硫具有还原性与酸性高锰酸钾反应,据此分析;
(7)G中为二氧化硫与硫化钠生成硫单质.
解答 解:(1)装置C中加热的仪器为酒精喷灯;
故答案为:酒精喷灯;
(2)步骤一中,停止加热后,继续通入O2的主要作用为使生成的SO2全部被装置D中的NaOH溶液吸收,减小误差;
故答案为:使生成的SO2全部被装置D中的NaOH溶液吸收,减小误差;
(3)沉淀为硫酸钡,23.3g,为0.1mol,根据硫元素守恒,故m(S)=n(S)×32=n(BaSO4)×32=3.2g,则铜元素质量为:16-3.2=12.8g,故x:y=n(Cu):n(S)=$\frac{12.8}{64}mol$:$\frac{3.2}{32}mol$=2:1,故该化合物为Cu2S;
故答案为:Cu2S;
(4)若无装置E,则D中氢氧化钠吸收空气中的二氧化碳,则测得的硫元素质量偏大,则x:y偏小;
故答案为:偏小;
(5)选用实验I中的装置A、B、C和图2所示装置,依次验证SO2的漂白性,氧化性和还原性,其中漂白性由品红溶液检验,氧化性用硫化钠检验,还原性由酸性高锰酸钾检验,最后用氢氧化钠吸收尾气二氧化硫,故连接顺序为A→B→C→I→G→H→J;
故答案为:I→G→H→J;
(6)试剂X为检验二氧化硫漂白性的试剂,为品红溶液,二氧化硫有还原性,与酸性高锰酸钾溶液发生氧化还原反应,使其褪色或变浅;
故答案为:品红溶液;装置H中酸性KMnO4溶液褪色或变浅;
(7)G中为二氧化硫与硫化钠反应生成硫单质,离子反应为:2S2-+2H2O+5SO2=3S↓+4HSO3-;
故答案为:2S2-+2H2O+5SO2=3S↓+4HSO3-.
点评 本题考查了物质化学式的确定和性质实验方案设计,侧重考查学生知识综合应用、根据实验目的及物质的性质进行排列顺、实验基本操作能力及实验方案设计能力,综合性较强,注意把握物质性质以及对题目信息的获取于使用,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | NaNO3溶液 | B. | MgC12溶液 | C. | BaC12溶液 | D. | FeC13溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为8的氮原子${\;}_{7}^{8}$N | |
| B. | 钠原子的结构示意图: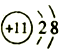 | |
| C. | 氧化钠的电子式: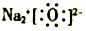 | |
| D. | 2-戊烯的结构简式:CH3CH2CH═CHCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
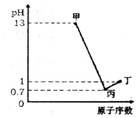 X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁,常温下甲、丙、丁均可与乙反应生成盐和水,X、Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )
X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁,常温下甲、丙、丁均可与乙反应生成盐和水,X、Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )| A. | 简单阴离子的还原性:Z<W | |
| B. | X、Y分别与W形成的化合物皆为离子化合物 | |
| C. | 乙固体中加入甲的溶液或浓氨水,固体都能溶解 | |
| D. | Y、Z的简单离子都会影响水的电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 107g Fe(OH)3胶体中胶体粒子的数目为NA | |
| B. | 1L 0.1 mol•L-1Na2CO3溶液中CO32-和HCO3-离子数之和为0.1 NA | |
| C. | 密闭容器中0.5mol H2与0.5mol I2充分反应,得到HI的分子数为NA | |
| D. | 30g由14C2H2和C18O组成的混合气体中含有的质子数为14NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 FeCl3溶液:K+、NH4+、I-、SO42- | |
| B. | 使酚酞变红色的溶液:Na+、Al3+、NO3-、Cl- | |
| C. | 0.1 mol•L-1 NH4HCO3溶液:K+、Na+、NO3-、Cl- | |
| D. | 由水电离的c(H+)=1×10-13 mol•L-1的溶液:Mg2+、Ca2+、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
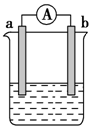 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com