
【题目】范德华力为a kJ·mol-1,化学键为b kJ·mol-1,氢键为c kJ·mol-1,则a、b、c的大小关系正确的是
A. a>b>cB. b>a>cC. c>b>aD. b>c>a
科目:高中化学 来源: 题型:
【题目】亚硫酰氯(俗称氯化亚砜,SOCl2)是一种液态化合物,沸点77℃,在农药、制药行业、有机合成等领域用途广泛。实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示:

请回答下列问题:
(1)仪器c的名称是__________________
(2)实验室用二氧化锰与浓盐酸共热反应的离子方程式为_______________________
(3)已知SOCl2遇水剧烈反应,液面上产生白雾,并常有刺激性气味的气体产生。蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3·6H2O混合加热,可得到无水AlCl3,试解释原因:_______________________________________________________
(4)装置e中产生的Cl2经过装置d(含两个洗气瓶)后进入三颈烧瓶,按Cl2的流向,第一个洗气瓶应放入的试剂是__________
(5)若反应中消耗Cl2的体积为896 mL(己转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76 g,则SOCl2的产率为__________(保留三位有效数字)。
(6)分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静置得到无色溶液W,检验溶液W中存在Cl-的方法是________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确( )
A. 烧碱溶液与氯化铵溶液混合: NH4++OH- = NH3·H2O
B. 硫酸铵溶液与氢氧化钡溶液混合加热:NH4++OH- = NH3↑+H2O
C. 氨气通入稀硫酸:NH3+H+=NH4+
D. 氯气通入水中:Cl2 + H2O = 2H++Cl-+ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥有较强还原性的HI、H2S等气体
B. 浓硫酸与单质碳反应的化学方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,在此反应中,浓硫酸既表现了强氧化性又表现了酸性
CO2↑+2SO2↑+2H2O,在此反应中,浓硫酸既表现了强氧化性又表现了酸性
C. 把足量铜粉投入到含H2SO4 2 mol的浓硫酸中,得到气体体积标准状况下为22.4 L
D. 常温下能够用铁、铝等容器盛放浓硫酸,是因为浓硫酸的强氧化性使其钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温、常压和光照条件下,N2在催化剂表面与H2O发生反应:2N2(g)+6H2O(l) =4NH3(g)+3O2(g)。在2 L的密闭容器中,起始反应物用量相同,催化剂的使用情况也相同,控制不同温度分别进行4组实验,3 h后测定NH3的生成量,所得数据如下表:
实验级别 | 实验1 | 实验2 | 实验3 | 实验4 |
温度/K | 303 | 313 | 323 | 353 |
NH3生成量/106mol | 4.8 | 5.9 | 6.0 | 2.0 |
下列说法不正确的是
A. 温度为303 K时,在3 h内用氮气表示的平均反应速率为4×107mol·L1·h1
B. 实验1和实验3中,3 h内N2的转化率之比为4:5
C. 分析四组实验数据可得出,温度升高可加快反应速率,也可能减慢反应速率
D. 353 K时,可能是催化剂催化活性下降或部分水脱离催化剂表面,致使化学反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的措施是( )
A. 向水中通入SO2 B. 将水加热煮沸
C. 向纯水中投入一小块金属钠 D. 向水中加入NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中相对位置如下图所示,若Y原子的最外层电子是次外层电子数的3倍,下列说法正确的是( )
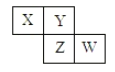
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 4种元素的单质中,Z单质的熔沸点最低
D. W单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸是二元弱酸,0.2 mol·L-1NaHC2O4溶液显酸性,关于NaHC2O4溶液中离子浓度关系的叙述不正确的是( )
A.c(Na+)>c(HC2O4—)>c(C2O42—)>c(H2C2O4)
B.c(Na+)=c(HC2O4—)+c(C2O42—)+c(H2C2O4)
C.c(Na+)+c(H+)=c(HC2O4—)+c(C2O42—)+c(OH-)
D.c(H+)+c(H2C2O4)=c(C2O42—)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氨基甲酸铵固体置于特制的密闭真空容器中(容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验测得不同温度下的部分平衡数据如下表:
2NH3(g)+CO2(g)。实验测得不同温度下的部分平衡数据如下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强/kPa | 5.7 | p1 | 12.0 | p2 | 24.0 |
平衡气体总浓度/10-3 mol·L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
下列说法中不正确的是
A. 混合气体的平均相对分子质量——M不再随时间变化时反应达平衡状态
B. 15.0 ℃时NH2COONH4(s)分解的平衡常数为2.0×10-9(mol/L)3
C. 该反应H>0,p2=2p1
D. 若在恒温下将平衡体系体积减半,再达平衡后,c(NH3)和c(CO2)均比原平衡大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com