
【题目】下列有关物质的性质与用途正确且具有对应关系的是
A.SO2具有氧化性,可用于漂白纸浆
B.NH4HCO3受热易分解,可用作氮肥
C.金属钠具有还原性,可从硫酸铜溶液中置换出铜
D.Al2O3熔点高,可用作耐高温材料
 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
【题目】实验室中需要配制0.2 mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称量的NaCl的质量分别是( )
A.1000 mL,l1.7gB.950mL,11.1 gC.500mL,11.7gD.100mL,11.7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中的可逆反应 2HI(g) ![]() I2(g) +H2(g) ,能说明反应达到平衡的是
I2(g) +H2(g) ,能说明反应达到平衡的是
A. 反应容器内压强不随时间变化而变化
B. 单位时间内消耗2moHI,同时生成1moH2
C. HI的浓度与I2的浓度相等
D. 混合气体的颜色不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯酮的结构简式为CH2=C=O,是一种重要的有机中间体,可由乙酸分子内脱水得到。下列说法不正确的是
A. 1mol乙烯酮与1molH2完全反应生成1mol乙醇
B. 乙烯酮中所有的原子均处于同一平面内
C. 乙烯酮与水反应生成乙酸的反应属于加成反应
D. 乙烯酮与![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑥六种元素在周期表中的位置:
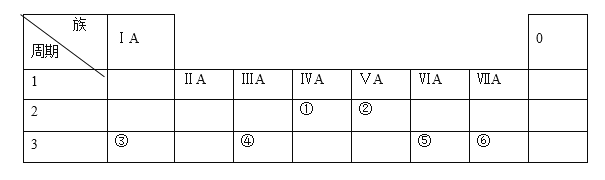
请按要求回答下列问题。
(1)元素①的元素符号是________。 元素②的单质电子式是_______。元素⑤的原子结构示意图是_______。
(2)③和⑥形成的化合物中所含化学键类型_______。
(3)HF沸点比⑥氢化物的沸点_____(高或低),原因是________。
(4)这六种元素中,位于第三周期且原子半径最小的是(填元素符号)________。
(5)这六种元素的最高价氧化物中,属于两性氧化物的元素是(填元素符号)___________。
(6)在盛有水的小烧杯中加入元素③的单质,发生反应的离子方程式为_________________。向上述反应后的溶液中再加入元素④的单质,发生反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)===CO2(g) ΔH1
CO2(g)+C(s)===2CO(g) ΔH2
2CO(g)+O2(g)===2CO2(g) ΔH3
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是
A. ΔH1>0,ΔH3<0B. ΔH2>0,ΔH4>0C. ΔH1=ΔH2+ΔH3D. ΔH3=ΔH4+ΔH5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的化工原料,工业上用N2和H2合成NH3。现己知N2(g)和H2(g)反应生成1 molNH3(g)过程中能量变化示意图如下图。则N-H键键能为
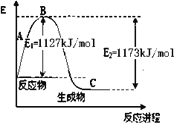
化学键 | H-H | N≡N |
键能(kJ/mol) | 436 | 946 |
A. 248kJ/molB. 391kJ/molC. 862kJ/molD. 431kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)f在周期表中的位置是___________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):______>______;比较g、h的最高价氧化物对应水化物的酸性强弱:_______。
(3)写出一种既含离子键又含极性共价键e的氧化物的电子式:_____。
(4)已知1 gX的单质在足量d2中燃烧,恢复至室温,放出142.9kJ热量,写出表示其燃烧热的热化学方程式:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com