
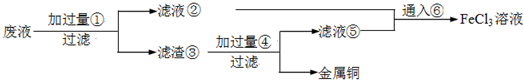
某化学兴趣小组利用废弃铝矿(含CuO、Al2O3及SiO2),模拟工业上提取铝的工艺,设计如下图所示的简单操作流程:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
|
|
|
|
开始沉淀 |
2.3 |
7.5 |
3.4 |
|
完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)滤渣主要成分的化学式为______________________。
(2)灼烧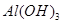 时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有___________(填仪器名称)。
时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有___________(填仪器名称)。
(3)溶液Y中要加入稍过量原料A,原料A的化学式是_________,步骤⑤反应的离子方程式是_______________________。
(4)操作流程中③的离子方程式为_______________________。
(5)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如图所示:

请写出该电池正极反应式_________________;常温下,用该化学电源和惰性电极电解300mL氯化钠溶液(过量),消耗27mg Al,则电解后溶液的pH=_________(不考虑溶液体积的变化)。
(6)以熔融盐为电镀液可以在钢材表面镀铝,镀铝电解池中,钢材为________极;镀铝后能防止钢材腐蚀,其原因是____________________________________。
(1)Cu、Fe、SiO2(2分)
(2)坩埚(1分)
(3)NH3•H2O(1分) Al3++3NH3•H2O=Al(OH)3↓+3NH4+(2分)
(4)2Fe2++H2O2+2H+=2Fe3++2H2O(2分)
(5)Ag2O+2e-+H2O=2Ag+2OH-(2分) 12(2分)
(6)阴(1分) 在空气中铝表面能形成一层致密的氧化膜,从而保护钢材不被腐蚀(2分)
【解析】
试题分析:该工艺流程原理为:铝矿加入硫酸,溶解氧化铜、氧化铝,加入过量铁粉,除去溶液中铜离子,过滤,滤渣中主要为Cu、Fe、SiO2,滤液X中含有铝离子、亚铁离子,再加入过氧化氢,将亚铁离子氧化为铁离子,通过调节pH值,使铁离子转化为氢氧化铁而除去,溶液Y含有铝离子,加入氨水,将铝离子转化为氢氧化铝沉淀,加热分解得氧化铝,电解氧化铝生成金属铝。(1)滤渣主要成分的化学式为:Cu、Fe、SiO2。(2)灼烧固体时,要用到坩埚。(3)沉淀Al3+的试剂为氨水,步骤⑤反应的离子方程式是:Al3++3NH3•H2O=Al(OH)3↓+3NH4+。(4)加入过氧化氢,将亚铁离子氧化为铁离子。操作③中的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。(5)正极上氧化银得电子和水反应生成银和氢氧根离子,电极反应式为:Ag2O+2e-+H2O=2Ag+2OH-;根据反应中得失电子数相等计算,消耗27mg Al失去电子0.003mol,则生成氢氧根离子的物质的量为0.003 mol,溶液中氢氧根离子的物质的量的浓度为0.003mol/0.3 L=0.01 mol·L-1,pH=12。(6)电镀池中镀层金属作阳极,待镀金属作阴极,故在钢材表面镀铝,镀铝电解池中,金属铝为阳极,钢材为阴极。在空气中铝表面能形成一层致密的氧化膜,从而保护钢材不被腐蚀。
考点:本题主要考查化工流程图的中综合分析。


科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
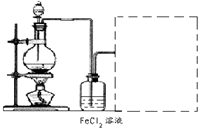
①将洗净后的废铁屑放在烧杯内,用过量的工业盐酸浸泡至不再产生气泡,过滤。
②按下图组装仪器,并检查装置的气密性,将①得到的滤液放入试剂瓶B中。
③在石墨电极X、Y上连接直流电源,通电,待FeCl2全部被氧化后,断开电源。
④试剂瓶B中的溶液经过一系列操作,可得FeCl3·6H2O晶体。
请回答下列问题:

(1)A中的X极应连接电源的___________极,A中发生的化学反应方程式为_____________;B中溶液颜色变化为______________。
(2)C烧杯中应盛放的试剂是______________,其作用是__________________________。
(3)试剂瓶B中的溶液由步骤④制得FeCl3·6H2O晶体,则步骤④需要进行的操作依次是(填序号)______________。
A.加热浓缩 B.洗涤、干燥 C.过滤 D.冷却结晶
(4)在整个实验过程中,盐酸必须保持过量,主要原因是__________________________。
查看答案和解析>>
科目:高中化学 来源:2012届山东省潍坊市高三上学期期末考试化学试卷 题型:实验题
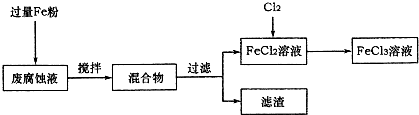
(16分)印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
(1)测得某废腐蚀液中含CuCl2 1.5 mol·L-1、FeCl23.O mol·L-1、FeCl3 1.0 mol·L-1、HCl3.0 mol·L-1。取废腐蚀液200mL按如下流程在实验室进行实验:
回答下列问题:
废腐蚀液中加入过量铁粉后,发生反应的离子方程式为 。
②检验废腐蚀液中含有Fe3+的实验操作是 ;
在上述流程中,“过滤”用到的玻璃仪器有烧杯、玻璃棒、 。
③由滤渣得到纯铜,除杂所需试剂是 。
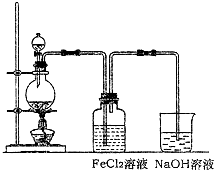
(2)某化学兴趣小组利用下图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液。
①实验开始前,某同学对实验装置进行了气密性检查,方法是 。
②浓盐酸与二氧化锰反应的化学方程式为 ;
烧杯中NaOH溶液的作用是 。
③参考(1)中数据,按上述流程操作,需称取Fe粉的质量应不少于 g,
需通入Cl2的物质的量应不少于 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组利用废铁屑制取FeCl3?6H2O晶体。主要步骤如下:
①洗净后的废铁屑放在烧杯内,用过量的工业盐酸浸泡至不再产生气泡,过滤。
② 按下图组装仪器,并检查装置的气密性,将①得到的滤液放入试剂瓶B中。
③ 在石墨电极X、Y上连接直流电源,通电,待FeCl2全部被氧化后,断开电源。
④ 试剂瓶B中的溶液经过一系列操作,可得FeCl3•6H2O晶体。
请回答下列问题:

(1)A中的X极应连接电源的 极,A中发生化学反应的方程式 ;
B中溶液颜色的变化 ,
(2)C烧杯中应该盛放的是 ,其作用是 。
(3)试剂瓶B中的溶液由步骤④制得FeCl3•6H2O晶体,④需要进行的操作依次是(填序号) 。
A.加热浓缩 B.洗涤 、干燥 C.过滤 D.冷却结晶
(4)在整个实验过程中,盐酸必须保持过量,主要原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com