
【题目】氯化锌(ZnCl2)可用作有机合成脱水剂、催化剂、缩合剂等。某实验小组在实验室采用HCl气体“置换”除水与ZnCl2升华相结合的方法从市售的氯化锌[含Zn(OH)Cl]制备高纯度无水氯化锌,装置如图所示。
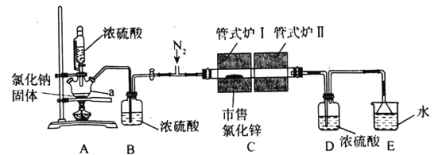
实验步骤:
①仪器连接完毕后,打开恒压滴液漏斗活塞,同时通入干燥纯净的N2。
②对管式炉I、管式炉II进行加热,管式炉I加热至150℃时开始反应,保持一段时间至置换除水完全再升温,继续升温约至550℃时不再有水蒸气蒸出。
③对管式炉I继续升温至770~800℃之间,至ZnCl2全部升华至管式炉II,停止加热管式炉I,并关闭恒压滴液漏斗活塞。
④继续通N2至尾气不再显酸性为止,在N2保护下将升华ZnCl2粉末分装在已知重量一端封闭的玻璃管中,用焊枪封口,称重,备用。
请回答下列问题:
(1)仪器a的名称为___,恒压滴液漏斗的作用为___。
(2)HCl气体“置换”除水的化学反应方程式为___。
(3)步骤②对管式炉II进行加热的目的为___。
(4)步骤②、③仍一直通入N2的目的分别为___、___。
(5)如无装置D,则会导致的后果为___。
【答案】三颈烧瓶 平衡压强,保证浓硫酸顺利滴下 Zn(OH)Cl+HCl![]() ZnCl2+H2O 保证炉Ⅰ中生成的水仍以气态存在 带走炉Ⅰ中生成的水蒸气 将炉Ⅰ中升华的ZnCl2全部带至炉Ⅱ中 装置E中的水蒸气进入管式炉Ⅱ中,无法收集到无水ZnCl2
ZnCl2+H2O 保证炉Ⅰ中生成的水仍以气态存在 带走炉Ⅰ中生成的水蒸气 将炉Ⅰ中升华的ZnCl2全部带至炉Ⅱ中 装置E中的水蒸气进入管式炉Ⅱ中,无法收集到无水ZnCl2
【解析】
由图可知,利用浓硫酸的高沸点、酸性,氯化钠固体、浓硫酸加热反应生成HCl,用浓硫酸干燥氯化氢;氯化锌升华进入管式炉Ⅱ,凝华得到高纯度无水氯化锌,实验结束时应该先撤去管式炉Ⅱ的加热,再撤去管式炉Ⅰ;D为干燥装置,防止氯化锌吸水潮解,E为尾气处理装置,避免氯化氢污染空气。
(1)a为三颈烧瓶,恒压滴液漏斗可以保证装置内部压强不变,使得恒压滴液漏斗与三颈烧瓶内压强相等,使浓硫酸顺利滴下;答案:三颈烧瓶;平衡压强,保证浓硫酸顺利滴下;
(2)在加热条件下装置D中Zn(OH)Cl和HCl反应生成ZnCl2和水,发生反应的化学方程式为Zn(OH)Cl+HCl![]() ZnCl2+H2O;
ZnCl2+H2O;
(3)步骤②对管式炉Ⅱ进行加热的目的是保证管式炉Ⅰ中生成的水仍以气态存在,水蒸气随HCl和氮气气流进入尾气吸收装置,然后将管式炉Ⅰ升至更高的温度使氯化锌升华进入管式炉Ⅱ的石英管,答案为:保证管式炉Ⅰ的生成的水仍以气态存在;
(4)步骤②、③通入N2的作用分别是带走炉Ⅰ中生成的水蒸气和带走升华的ZnCl2气体使其到达炉Ⅱ中,答案:带走炉Ⅰ中生成的水蒸气;将炉Ⅰ中升华的ZnCl2全部带至炉Ⅱ中;
(5)装置D的作用是防止装置E中的水蒸气进入管式炉Ⅱ,若无装置D,则无法收集到无水氯化锌,答案:装置E中的水蒸气进入管式炉Ⅱ,无法收集到无水氯化锌。


科目:高中化学 来源: 题型:
【题目】在“宏观——微观——符号”之间建立联系是化学学科特有的思维方式。如图是科研人员提出的HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程示意图(图中只画出了HAP的部分结构)。下列说法不正确的是
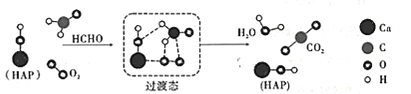
A.HAP能降低HCHO与O2反应的活化能
B.该反应的化学方程式为HCHO+O2![]() CO2+H2O
CO2+H2O
C.反应过程中断裂或生成的的化学键类型均为极性共价键
D.产物CO2分子中的氧原子不仅仅来源于O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢大量存在于天然气及液化石油气中,近年来发现![]() 可用于制取氢气、合成硫醇等。回答下列问题:
可用于制取氢气、合成硫醇等。回答下列问题:
(1)D.Berk等学者设计的用FeS催化分解![]() 包括下列反应:
包括下列反应:
Ⅰ.![]()
Ⅱ.![]()
Ⅲ.![]()
①![]() =____________(用
=____________(用![]() 表示)。
表示)。
②已知单质硫气态时以![]() 形式存在(结构为S=S)。键能E(H-S)=339
形式存在(结构为S=S)。键能E(H-S)=339![]() 、E(H-H)=436
、E(H-H)=436![]() 、E(S=S)=225
、E(S=S)=225![]() ,则
,则![]() =____________
=____________![]() 。
。
③![]() 是离子化合物,Fe显+2价,
是离子化合物,Fe显+2价,![]() 的电子式为______________。
的电子式为______________。
(2)银器长期露置在含![]() 的空气中表面会生成
的空气中表面会生成![]() 而变黑,该反应的氧化剂为________;将表面变黑的银器放在盛有食盐水的铝制容器中煮沸,表面重新变为光亮,正极发生的电极反应为________。
而变黑,该反应的氧化剂为________;将表面变黑的银器放在盛有食盐水的铝制容器中煮沸,表面重新变为光亮,正极发生的电极反应为________。
(3)实验室用粗锌制取氢气时常含有少量的![]() ,可用酸性
,可用酸性![]() 溶液(
溶液(![]() 被还原为
被还原为![]() )将
)将![]() 氧化为S而除去,该反应的离子方程式为_______。
氧化为S而除去,该反应的离子方程式为_______。
(4)![]() 与
与![]() 合成硫醇
合成硫醇![]() 的反应
的反应![]() 在不同温度及不同物质的量之比时
在不同温度及不同物质的量之比时![]() 的平衡转化率如图所示:
的平衡转化率如图所示:
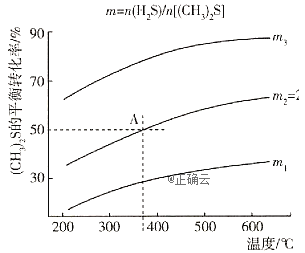
①该反应的![]() ______0(填“>”或“<");
______0(填“>”或“<");![]() _________
_________![]() (填“>”或“<”)。
(填“>”或“<”)。
②在2L密闭容器中充入0.2mol![]() 和0.1mol
和0.1mol![]() ,在A点达到平衡时,A点对应温度下反应的平衡常数为K=_________。
,在A点达到平衡时,A点对应温度下反应的平衡常数为K=_________。
③为提高![]() 的平衡转化率,除改变温度及投料比(m)外,还可采取的措施是_____
的平衡转化率,除改变温度及投料比(m)外,还可采取的措施是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向温度为300℃的2 L密闭容器中充入2 mol SO2和1 mol O2,发生反应2SO2 (g)+ O2 (g) ![]() 2SO3(g)△H<0,体系达到平衡状态后SO2的浓度为0.1 mol/L,下列说法错误的是
2SO3(g)△H<0,体系达到平衡状态后SO2的浓度为0.1 mol/L,下列说法错误的是
A.该温度下,反应的平衡常数K =1620
B.SO2和O2的平衡转化率相等
C.平衡后保持温度和容器体积不变,再充入SO3(g),平衡常数不变
D.若不再向容器中加入任何物质,仅改变条件不可能使SO2的浓度达到1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上将石灰石和硫煤混合使用,称之为“固硫”,其反应原理为:2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g) △H1=akJ·mol-1。
2CaSO4(s)+2CO2(g) △H1=akJ·mol-1。
已知:CaO(s)+CO2(g)![]() CaCO3(s) △H2=bkJ·mol-1;
CaCO3(s) △H2=bkJ·mol-1;
2SO2(g)+O2(g)![]() 2SO3(g) △H3=ckJ·mol-1。
2SO3(g) △H3=ckJ·mol-1。
请回答下列问题:
(1)CaSO4(s)![]() CaO(s)+SO3(g)△H=___kJ·mol-1(用a、b、c表示)。
CaO(s)+SO3(g)△H=___kJ·mol-1(用a、b、c表示)。
(2)T1℃时,向某恒容密闭容器中通入一定量的CO2和足量CaO发生反应:CaO(s)+CO2(g)![]() CaCO3(s),CO2的浓度随时间变化如图所示:
CaCO3(s),CO2的浓度随时间变化如图所示:
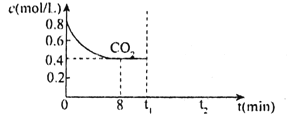
①0~8min,v(CO2)=___。
②t1min时,若保持其他条件不变,压缩容器体积至原来的![]() ,t2min重新达到平衡,请在图中画出CO2的浓度自条件改变至新平衡的变化曲线___。
,t2min重新达到平衡,请在图中画出CO2的浓度自条件改变至新平衡的变化曲线___。
(3)T2℃时,向某密闭容器中通入2molSO2和1molO2发生反应:2SO2(g)+O2(g)![]() 2SO3(g) △H3=ckJ·mol-1。
2SO3(g) △H3=ckJ·mol-1。
①若该容器为恒压密闭容器,下列选项可判断反应已达平衡状态的是___。
A.混合气体的密度不再改变
B混合气体的压强不再改变
C.相同时间内,每断裂0.1molO=O键,同时生成0.2molSO3
D.混合气体的平均相对分子质量不再改变
②若该容器为2L的恒容密闭容器,达平衡时SO3的体积分数为40%,则O2的转化率为___,T2℃时该反应的平衡常数K=___。
③反应达到②中的平衡状态后,保持反应温度和O2的浓度不变,增大容器体积,则平衡将___(填“正向”、“逆向”或“不“)移动,原因为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】比亚迪公司开发了锂钒氧化物二次电池。电池总反应为V2O5+xLi![]() LixV2O5,下列说法正确的是
LixV2O5,下列说法正确的是
A.该电池充电时,锂电极与外加电源的负极相连
B.该电池放电时,Li+向负极移动
C.该电池充电时,阴极的反应为LixV2O5-xe-=V2O5+xLi+
D.若放电时转移0.2mol电子,则消耗锂的质量为1.4xg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中: Fe3+、Mg2+、SCN 、Cl
B.![]() =1×10-12的溶液中:K+、Na+、CO32、NO3
=1×10-12的溶液中:K+、Na+、CO32、NO3
C.![]() 的溶液中: K+、NH4+、MnO4、SO42-
的溶液中: K+、NH4+、MnO4、SO42-
D.能使甲基橙变红的溶液中: Na+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家经过研究发现,CO2 与 H2 在催化剂作用下可转化成 CH3OH 燃料,是一种减排、环保的有效方法。该可 逆反应发生过程中的能量变化如图所示,下列说法错误的是

A.CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g)为吸热反应
CO2(g)+3H2(g)为吸热反应
B.使用催化剂 x 时,正反应的活化能 = △H + 逆反应活化能
C.其他条件一定,与其他催化剂相比,使用催化剂 z 时,反应物 转化率可能更高
D.从图中可知,选用不同的催化剂,反应的△H也不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Z常用于治疗心律失常,Z可由有机物X和Y在一定条件下反应制得,下列叙述正确的是
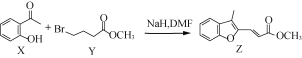
A.X中所有原子可能在同一平面内
B.X、Z均能与酸性KMnO4溶液反应
C.1 mol Y最多能与2 mol NaOH反应
D.室温下Z与足量Br2加成产物的分子中有2个手性碳原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com