
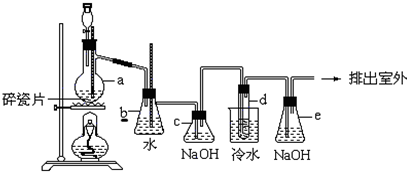
分析 装置a中乙醇在浓硫酸做催化剂条件下发生消去反应生成乙烯,b为安全瓶可以防止倒吸,当e堵塞时,气体不畅通,则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管.制取乙烯中含有二氧化碳、二氧化硫等,用氢氧化钠溶液吸收二氧化碳、二氧化硫,d装置中乙烯与液溴发生加成反应生成1,2-二溴乙烷,液溴易挥发,反应过程中应用冷水冷却装置d,能减少液溴挥发,E装置吸收挥发的溴,防止污染空气.
解答 解:装置a中乙醇在浓硫酸做催化剂条件下发生消去反应生成乙烯,b为安全瓶可以防止倒吸,当e堵塞时,气体不畅通,则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管.制取乙烯中含有二氧化碳、二氧化硫等,用氢氧化钠溶液吸收二氧化碳、二氧化硫,d装置中乙烯与液溴发生加成反应生成1,2-二溴乙烷,液溴易挥发,反应过程中应用冷水冷却装置d,能减少液溴挥发,E装置吸收挥发的溴,防止污染空气.
(1)乙醇发生消去反应生成乙烯的反应方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)制备1,2-二溴乙烷的化学方程式:CH2=CH2+Br2→CH2BrCH2Br,
故答案为:CH2=CH2+Br2→CH2BrCH2Br;
(3)试管d发生堵塞时,b中压强不断增大,会导致b中水面下降,玻璃管中的水柱上升,甚至溢出,
故答案为:b中水面会下降,玻璃管中的水面会上升,甚至溢出;
(4)制备的乙烯中混有二氧化碳、二氧化硫,二氧化硫能与溴发生氧化反应,装置c的作用是:,
故答案为:除去乙烯中二氧化碳、二氧化硫;
(5)当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多的原因可能是乙烯发生(或通过液溴)速度过快,导致大部分乙烯没有和溴发生反应;乙醇和浓硫酸的混合液没有迅速达到170℃会导致副反应的发生和副产物的生成,乙醇在浓硫酸140℃的条件下,发生分子键脱水生成乙醚,
故答案为:①乙烯发生(或通过液溴)速度过快;②实验过程中,乙烯和浓硫酸的混合液没有迅速达到170℃;
(5)尾气中含有挥发出的溴,会污染大气,应该进行尾气吸收,所以装置e中氢氧化钠溶液的作用是吸收Br2气体,防止大气污染,
故答案为:吸收挥发出来的溴,防止污染环境.
点评 本题考查制备有机物制备实验,关键理解制备原理与各装置作用,注意乙烯制备中发生的一些副反应,试题培养学生分析问题、解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶于水:NaHCO3═Na++H++CO32- | |
| B. | H2CO3?2H++CO32- | |
| C. | Al(OH)3酸式电离:Al(OH)3═H2O+AlO2-+H+ | |
| D. | NaHSO4熔化:NaHSO4═Na++HSO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | NaClO | C. | NaCl | D. | Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol/L | B. | 2.0 mol/L | C. | 3.0 mol/L | D. | 4.0 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水中溶解性:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3<NaHCO3 | |
| C. | 与酸反应的速度:Na2CO3>NaHCO3 | |
| D. | Na2CO3不能转化成NaHCO3,而NaHCO3能转化为Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com