
【题目】金和铜可以形成多种金属化合物,其中一种晶体的结构如图所示(为面心立方体结构). 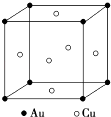
(1)该金属化合物的化学式为 .
(2)已知Au 的相对原子质量为197,Cu的相对原子质量为64,阿伏加德罗常数为NA , 若该化合物的密度为dgcm﹣3 , 试计算面上距离最近的两个金原子的核间距为cm.
科目:高中化学 来源: 题型:
【题目】下列过程中所发生的化学变化属于取代反应的是
A. 一定条件下乙醇和氧气反应生成乙醛 B. 乙烯通入溴水中
C. 乙烯合成聚乙烯 D. 光照射甲烷和氯气的混合气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) mol/L | 实验 温度/℃ | 金属消失 的时间/s |
1 | 0.10 | 丝 | 0.7 | 20 | 250 |
2 | 0.10 | 丝 | 1.0 | 20 | 200 |
3 | 0.10 | 粉末 | 1.0 | 20 | 125 |
4 | 0.10 | 粉末 | 1.0 | 30 | 50 |
分析上述数据,回答下列问题:
(1)①实验1、2可得出的结论是,硫酸浓度越_____,反应速率越慢;
②实验3、4可得出的结论是温度越_____,反应速率越快.
(2)①用铁粉和稀硫酸反应制取H2,实验过程中绘制出生成H2的体积(V)与时间(t)的关系如图所示. 试分析判断OE段、EF段、FG段、GH段反应速率(分别用v (OE)、v (EF)、v (FG)、v (GH)表示)最快时段是______.
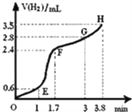
A.v (OE) B.v (EF)C.v (FG) D.v (GH)
②1min内反应较慢的原因是:_________;一段时间后反应明显加快的原因是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摄入过多的反式脂肪酸,容易堵塞血管而导致心脑血管疾病。顺式脂肪酸、反式脂肪酸的结构如下图所示。

试回答下列问题:
(1)顺、反式脂肪酸中所含相同官能团名称是____________。
(2)上述顺式脂肪酸的分子式为________。
(3)上述顺、反式脂肪酸不可能具备的下列化学性质是________(填序号)。
A.能使酸性高锰酸钾溶液褪色
B.1 mol顺式脂肪酸最多与2 mol氢气发生加成反应
C.能与乙醇发生酯化反应
D.能与溴发生加成且生成物相同
(4)顺式脂肪酸多为液态,空间呈弯曲状,反式脂肪酸多为固态,空间呈线型。油脂长时间高温加热,会产生反式脂肪酸,人类长期食用油炸食品,血液中反式脂肪酸过高容易堵塞血管而导致心脑血管疾病。这说明反式脂肪酸比顺式脂肪酸的硬度________(填“大”或“小”),熔点________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)俗名海波,又名“大苏打”,是无色单斜晶体。易溶于水,不溶于乙醇,具有较强的还原性,广泛地应用于照相等工业中。回答下列问题:
(1)Na2S2O3·5H2O属于______(填“纯净物”或“混合物”)。
(2)酸性条件下,S2O32-自身发生氧化还原反应生成SO2。试写出Na2S2O3与盐酸反应的离子方程式:_____。
(3)亚硫酸法制备Na2S2O3·5H2O简易流程如下:
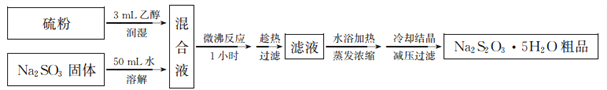
①Na2S2O3·5H2O制备原理为_________________(用化学方程式表示)。
②Na2S2O3·5H2O粗品中可能含有Na2SO3、Na2SO4杂质,其检验步骤为:取适量产品配成稀溶液,滴加足量氯化钡溶液,有白色沉淀生成;将白色沉淀过滤,先用蒸馏水洗涤沉淀,然后向沉淀中加入足量____(填试剂名称),若_______________(填现象),则证明产品中含有Na2SO3和Na2SO4(已知:Na2S2O3稀溶液与BaCl2溶液无沉淀生成)。
③粗品中Na2S2O3·5H2O的质量分数的测定
称取6g粗品配制250 ml.的溶液待用。另取25 ml.0.01 mol/L K2Cr2O7溶液于锥形瓶中,然后加入过量的KI溶液并酸化和几滴淀粉溶液,立即用配制的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液25mL。粗品中Na2S2O3·5H2O的质量分数为________。已知Cr2O72-+6I-+ 14 H+ =2Cr3++ 3I2+7H2O、I2+2S2O32- =2I-+S4O62-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,氯化亚硝酰(NOCl)足一种红黄色气体,其熔点- 64.5℃,沸点-5.5℃,可被水分解,其一种制备原理为Cl2+2NO =2NOC1。实验装置如下图所示,回答下列问题:

(1)实验前须排尽装置I、Ⅱ、Ⅲ中的空气,其原因是__________________________。
(2)NO是用铜与稀硝酸反应制得,其离子方程式为__________________________。
(3)图中各装置连接顺序为a→________________(按气流自左向右方向,用小写字母表示)。
(4)装置I、Ⅱ的作用是观察气泡调节气体的流速和________________________________。
(5)装置V是为了吸收尾气,防止污染环境,其中吸收NOC1时反应的化学方程式为____________(非氧化还原反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬酸铁铵[(NH4)3Fe( C6 H5O7)2,摩尔质量488 g/mol] 是一种重要的食品添加剂。一种制备柠檬酸铁铵的实验步骤如下:

步骤1.在右图三颈烧瓶中加入16.7 g FeSO4·7H2O、40 ml.蒸馏水,3mL硫酸和1 g NaClO3,强力搅拌;
步骤2.升温至80℃,再补加l g NaClO3;
步骤3.向反应器中加入NaOH溶液,温度控制在80~90℃,剧烈搅拌;
步骤4.过滤,洗涤,沥干,得活性Fe(OH)3;
步骤5.将Fe(OH)3和一定量的水加入三颈烧瓶中,控制95℃以上,加入计算量的柠檬酸溶液,搅拌,并保温1h;
步骤6.冷却到50℃,搅拌下加入氨水40 mL,静置、浓缩至膏状,80℃干燥得柠檬酸铁铵24.9 g。
回答下列问题:
(1)步骤1发生反应的离子方程式为_____________________________。
(2)步骤2再补加NaClO3的目的是_____________________________。
(3)步骤3确定Fe3+已沉淀完全的方法是_____________________________。
(4)步骤4过滤时,所需硅酸盐质仪器除烧杯外,还需要_____________________________;证明Fe(OH)3已被洗涤干净的方法为__________________________。
(5)柠檬酸铁铵的产率为_________(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关仪器的使用方法或实验操作正确的是( )
A.用碱式滴定管量取13.60mL酸性高锰酸钾溶液
B.测定硫酸铜晶体结晶水含量时,加热后的坩埚须在干燥器中冷却,再称量
C.蒸馏时,应使温度计水银球置于蒸馏液体中
D.过滤时,先将滤纸湿润,然后再将滤纸放入漏斗中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com