
有下列三个氧化还原反应:①2FeCl3+2KI===2FeCl2+2KCl+I2;②2FeCl2+Cl2===2FeCl3;③2KMnO4+16HCl(浓)===2KCl+2MnCl2+8H2O+5Cl2↑.
若某溶液中有Fe2+和I-共存,要氧化除去I-而又不影响Fe2+和Cl-,可加入的试剂是 ( )
A.Cl2 B.KMnO4
C.FeCl3 D.HCl
科目:高中化学 来源: 题型:
对于碳及其化合物间转化的说法中,正确的是( )
A.大气中CO2含量的剧增,对自然界中碳及其化合物间的平衡没有影响
B.木炭燃烧过程中,存在碳单质、CO和CO2之间的转化
C.碳的氧化物间的相互转化不属于氧化还原反应
D.含碳的无机化合物和有机化合物之间存在着严格的界限,无机化合物不能合成有机化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
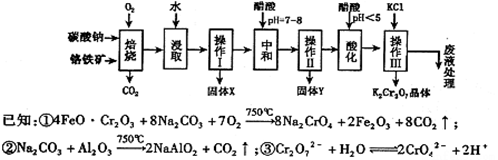
根据题意回答下列问题:
(1)操作Ⅰ的名称是 ,固体X中主要含有 (填写化学式);
(2)用醋酸调节溶液pH=7~8后再进行操作Ⅱ所得固体Y的成分为 (写化学式).
(3)酸化步骤中调节溶液pH<5时发生反应2CrO42-+2H+ 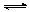 Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为 .
Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为 .
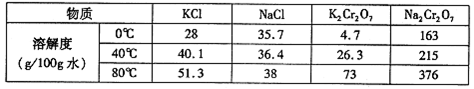
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是
Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl。该反应在溶液中能发生的理由是: 。
(5)含铬废渣(废水)的随意排放对人类生存环境有极大的危害。电解法是处理铬污染的一种方法,金属铁作阳极、石墨作阴极电解含Cr2O72-的酸性废水,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。
 ①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3): n (H2)=1:1)
①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3): n (H2)=1:1)
___Fe+___Cr2O72-+___ +___H2O =___Fe(OH)3↓+___Cr(OH)3↓+___H2↑;
②已知常温下Cr(OH)3的Ksp=6.4×10–32mol4/l4,若Ⅰ类生活饮用水水质标准铬含量最高限值是0.052 mg/L,要使溶液中c(Cr3+)降到符合饮用水水质标准,须调节溶液的pH大于______。
(已知lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
含氮废水进入水体中对环境选成的污染越来越严重。某校环保小组的同学认为可以用金属铝将水中的NO3-还原成N2,从而消除污染。
(1) 配平以下有关的离子反应方程式:
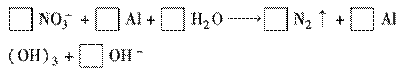
(2)以上反应中失电子的物质是________,还原产物是________,每生成1 mol这种还原产物,将有________电子发生转移。
(3)现需除去1  m3含氮0.3 mol的废水中的NO3-(设氮元素都以NO3-的形式存在),则至少需要消耗金属铝________。
m3含氮0.3 mol的废水中的NO3-(设氮元素都以NO3-的形式存在),则至少需要消耗金属铝________。
(4)你对以上治理污染的方案有何评价?
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是
A.生成42.0LN2(标准状况)
B.有0.250molKNO3被氧化
C.转移电子的物质的量为1.25mol
D.被氧化的N原子的物质的量为3.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室将NaClO3和Na2SO3按物质的量之比2∶1倒入烧瓶中,用水浴加热,同时滴入H2SO4,产生棕黄色气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为( )
A.Cl2 B.Cl2O
C.ClO2 D.Cl2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
Al、Fe、Cu都是重要的金属元素。下列说法正确的是 ( )
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置 在空气中均只生成氧化物
在空气中均只生成氧化物
C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,在0.2mol/LAl2(SO4)3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是
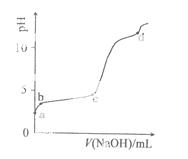
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:
Al3++3OH- Al
Al (OH)3
(OH)3
B.a→b段,溶液pH增大,Al3+浓度不变
C.b→c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com