
 传统中药的砷剂俗称“砒霜”,请回答下列问题:
传统中药的砷剂俗称“砒霜”,请回答下列问题:| NH3 | PH3 | AsH3 | |
| 键角/° | 107.8 | 93.6 | 91.8 |
| 熔点/℃ | -77.74 | -134 | -117 |
| 5+3 |
| 2 |


科目:高中化学 来源: 题型:
13 6 |
12 6 |
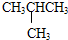
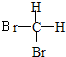 和
和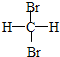 E.CH4和CH3(CH2)2CH3
E.CH4和CH3(CH2)2CH3查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学欲探究Cl2、Br2、I2之间的变化:
某同学欲探究Cl2、Br2、I2之间的变化:查看答案和解析>>
科目:高中化学 来源: 题型:
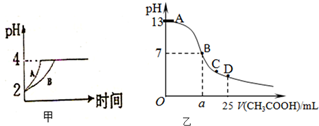 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe+H2SO4 |
| B、Cu+HNO3 |
| C、NaOH+CO2 |
| D、AlCl3+NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.15 mol?L-1 |
| B、0.30 mol?L-1 |
| C、0.225 mol?L-1 |
| D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇和乙酸均可以使酸性高锰酸钾溶液褪色 |
| B、淀粉、油脂、蛋白质在一定条件下都能发生水解反应 |
| C、正丁烷比异丁烷的沸点高 |
| D、乙醇和乙酸均能与金属钠能反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com