
���������2���֣���14�֣�
��8�֣�X��Y��Z��W��Ϊ������Ԫ����ɵĵ��ʻ����һ��������������ת����ϵ�� X��Y��Z��W
��1��������X�����������Ӹ�����Ϊ1�U2���ҹ���X�������������зֱ���18����10�����ӣ�����Z�������������о�����10�����ӡ���Z�ĵ���ʽΪ ��
��2����X��Y��Z��W�������ʾ�Ϊ���ӣ���X�����к�18�����ӣ�Y��Z�����о�����10�����ӣ�����W�����к���16�����ӡ���˻�ѧ��Ӧ������Ϊ ��
��3����X��W��Ϊ���ʣ�Y��Z��Ϊ��������Y��Z���������������ֱ�Ϊ50%��40%����÷�Ӧ�Ļ�ѧ����ʽΪ ��
��4����X��Y��Z��W��Ϊ�ǽ��������X��ʽ����Z��ʽ��С16��Y��ʽ����W��ʽ����16��Y�ǹ⻯ѧ��������Ҫ��Ԫ�ס�����÷�Ӧ�Ļ�ѧ����ʽΪ ��
��6�֣���������ijЩ��Ԫ�صĺ��⻯���P�临����ϵ��Ϊ��Դ�ܵ��㷺��ע��������A��XYH2����B��XH�����Ǿ���DZ��Ӧ�ü�ֵ��������ϡ�A���ȷֽ����ɹ��廯����C���ų��̼�������D��D��ʹʪ���pH��ֽ������B��XԪ�ص���������Ϊ87.5%��A��B��Ͽ��Ż��������ܡ��о����֣��û����ϵ�ķ��ⷴӦ���������У���1��2A = C + D ��2��D + B = A + H2 ��3��C + B = E + H2
��5��XԪ�ص�����Ϊ ��
��6��д��A��B��Ϸ���Ļ�ѧ��Ӧ����ʽ�� ��
��7��A��C��E����ˮ��������ͬ���IJ����д������C��ˮ��Ӧ�Ļ�ѧ����ʽ�� ��
��1�� ��2�֣�
��2�֣�
��2���û���Ӧ��������ԭ��Ӧ�� ��3��2Mg��SO2 2MgO��S��2�֣�
2MgO��S��2�֣�
��4��SO2��NO2��SO3��NO����CO��NO2��CO2��NO����2�֣�
��5��ﮣ�2�֣���6��2LiNH2 +LiH = Li3N+2 H2 �� ��2�֣�
��7��Li2NH+2H2O= 2LiOH+ NH3 ����2�֣�
��������
�����������1��������X�����������Ӹ�����Ϊ1�U2���ҹ���X�������������зֱ���18����10�����ӣ�����Z�������������о�����10�����ӣ������������ת���ǹ���������ˮ�ķ�Ӧ����X�ǹ������ƣ�Y��ˮ��Z���������ƣ�W������������Z�ĵ���ʽΪ ��
��
��2����X��Y��Z��W�������ʾ�Ϊ���ӣ���X�����к�18�����ӣ�Y��Z�����о�����10�����ӣ�����W�����к���16�����ӡ������������ת����������H2S��Ӧ���ɵ���S��ˮ���˻�ѧ��Ӧ������Ϊ�û���Ӧ��
��3����X��W��Ϊ���ʣ�Y��Z��Ϊ�������˵����Ӧ���û���Ӧ������ΪY��Z���������������ֱ�Ϊ50%��40%����÷�Ӧ�Ļ�ѧ����ʽΪ2Mg��SO2 2MgO��S��
2MgO��S��
��4����X��Y��Z��W��Ϊ�ǽ��������X��ʽ����Z��ʽ��С16��Y��ʽ����W��ʽ����16����˵������ʽ���仯������Ԫ�أ�Y�ǹ⻯ѧ��������Ҫ��Ԫ�ס�����Ϊ����������NO2����÷�Ӧ�Ļ�ѧ����ʽΪSO2��NO2��SO3��NO����CO��NO2��CO2��NO����
��A���ȷֽ����ɹ��廯����C���ų��̼�������D��D��ʹʪ���pH��ֽ���������D�ǰ�������A�Ļ�ѧʽӦ����LiNH2��C�Ļ�ѧʽ��Li2NH������C��ˮ��Ӧ�Ļ�ѧ����ʽΪLi2NH+2H2O= 2LiOH+ NH3 ����B��XԪ�ص���������Ϊ87.5%��A��B��Ͽ��Ż��������ܣ�����B��LiH�����߷�Ӧ�ķ���ʽΪ2LiNH2 +LiH = Li3N+2 H2 ����
���㣺��������ͼ���ƶ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ������ѧ�ڵڶ���������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA��ʾ�����ӵ�������ֵ������������ȷ����
A���ڷ�ӦKIO3 + 6 HI = KI + 3I2 + 3 H2O�У�ÿ����3mo1 I2ת�Ƶĵ�����Ϊ5NA
B�������£�28.0g��ϩ�Ͷ�ϩ�Ļ�������к��е�̼ԭ����ĿΪ3NA
C����1L0.1mol��L-1̼������Һ�У�����������С��0.1NA
D��1mol Na2O2 �����к���������Ϊ4 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ������ѧ�ڵ�һ��ͳ����ѧ�Ծ��������棩 ���ͣ�ѡ����
������������ijЩ���⣬���漰����ѧ֪ʶ������˵������ȷ����
A��Mg��OH��2��Al��OH��3�ȷֽ����ɵ���̬ˮ�ɸ��ǻ��桢����O2��ϡ�Ϳ�ȼ���壬�ֽ����MgO��Al2O3�ܽϿ��������ȼ�չ����в��������Լ���ʴ�����巴Ӧ���������ǿ�����Ϊδ����չ���������ȼ��
B�������������в���H7N9ʱ�в������棬��������ǿ��Ҫ��������Ӵ����ݣ�����ҲӦ��ǿ����Ԥ������������������ѡ�ú������������ƾ���˫��ˮ�����˵�����
C��ʳƷ��װ���г�����С������ʯ�ң�Ŀ���Ƿ�ֹʳƷ��������
D�������������ˮ����ȡ�塢ʯ�͵ķ�����������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ������ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����Ȼ�ѧ����ʽ�еġ�H�ܱ�ʾ��ȼ���ȼ���ȵ���
A��2H2S(g)+O2(g)=2S (s)+2H2O(l) ��H=�DQ2 kJ/mol
B��CH4(g)+2O2(g)==CO2(g)+2H2O(g); ��H=��802.3kJ/mol
C��CO(g)+1/2O2(g)==CO2(g); ��H=��283kJ/mol
D��2H2(g)+O2(g)==2H2O��1��; ��H=��571.6kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ������ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����йػ�ѧ�����ʾ��ȷ����
A��������Ϊ20����ԭ�ӣ�
B��NH3���ӵĵ���ʽ��
C����ԭ�ӵĽṹʾ��ͼ��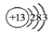
D���۱�ϩ�Ľṹ��ʽΪ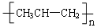
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ����10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ��ij�о�С����õ�ⷨ����ʯ�����ƹ����в����Ĵ���H2S�����Ĺ������̡��÷�����H2S�������ʴ�99%���ϣ�������ȡH2��S������˵����ȷ����
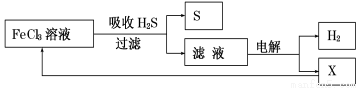
A������H2S�����ӷ���ʽΪ��2Fe3����H2S =2Fe2����S����2H��
B�����ʱѡ�������ӽ���Ĥ���������е���������Ӧ��ҪΪ��2Cl����2e�� = Cl2
C��������������������2.24L���壬������������0.2mol Fe3��
D��ʵ���ҿ��õ�ȼ���ȼ�յķ�������H2S��Ⱦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ����10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�ڵ��ۡ��⻯����Һ�м�����������������Һ��������������ϡ���ᣬ��Һ������������������Һ�м�������������������Һ����ɫ����ʧ�������жϲ���ȷ����
A�������ԣ�ClO����I2��SO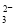 B��Ư����Һ��ʹ���۵⻯����ֽ����
B��Ư����Һ��ʹ���۵⻯����ֽ����
C���������ƿ������������ƹ��� D������ˮ�м�������������Һ����ˮ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����֣���и����ϵ�һ�Σ�10�£��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
24 mL 0.05 mol/L�� Na2SO3ǡ����20 mL 0.02 mol/L��K2R2O7��Һ��ȫ��Ӧ����RԪ���ڻ�ԭ�����еĻ��ϼ�Ϊ�� ��
A��0 B��+2 C��+3 D��+6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ�����и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
����������һ�ֹ�ҵ�Σ���������������Ӧ�ù㷺��������ͼ��ʾ�������г�װ����ʡ�ԣ���ҩƷ��̽����������������ķ�Ӧ�������������ijɷ֣�
��֪����NO��NO2��2OH��=2NO2����H2O ������Һ�����¶ȣ�NO2��21�桢NO:��152��
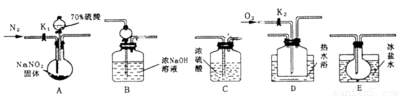
��1��Ϊ�˼���װ��A�����ɵ�����������������˳��Ϊ������������ӣ���A��C�� �� ��B��
��2���رյ��ɼ�K1����Һ©������������70%�����A�в�������ɫ���壮
��ȷ��A�в����������к���NO�����ݵ�������___________________��
��װ��E��������__________________________��
��3�������D��ͨ�����O2����װ��B�з�����Ӧ�Ļ�ѧ����ʽΪ ��
���û��װ��C����ʵ�������ɵ�Ӱ����_________________________��
��4��ͨ������ʵ��̽�����̣��ɵó�װ��A�з�Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com