
分析 (1)用已经称量完的氯化钠配制500mL、0.2mol•L-1的NaCl溶液,涉及的步骤有:称量,溶解氯化钠,用到烧杯和玻璃棒;转移溶液,用到玻璃棒和500mL容量瓶;洗涤烧杯和玻璃棒;定容溶液,用到胶头滴管,据此进行解答;
(2)根据m=nM=cVM计算;
(3)操作步骤有称量、溶解、移液、洗涤、定容、摇匀等,根据具体要求回答;
(4)结合c=n/V及不当操作对n、V的影响分析.
解答 解:(1)操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取药品,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,
故答案为:①③④⑥⑦⑧;
(2)m=nM=cVM=0.5L×0.2mol/L×58.5g/mol=5.9g,
故答案为:5.9;
(3)将NaCl固体溶解后,冷却片刻,随后全部转移到500mL的容量瓶中,转移时应用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀.然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度线下1~2cm处改用胶头滴管加蒸馏水到瓶颈刻度的地方,使溶液的凹液面最低处与刻度线相切,振荡、摇匀后,装瓶、贴签,
故答案为:500、引流、烧杯和玻璃棒、线下1~2cm、胶头滴管、凹液面最低处与刻度线相切;
(4))①转移前,容量瓶中含有少量蒸馏水,n、V均无影响,则浓度不变,故不选;
②所用过的烧杯、玻棒未洗涤,n减小,则由c=n/V可知,浓度偏小,故不选;
③定容时,俯视标线观察,V偏小,由c=n/V可知,浓度偏高,故选;
④定容时,加蒸馏水超过标线,又用胶头滴管吸出,V偏大,由c=n/V可知,浓度偏小,故不选.
故答案为:③.
点评 本题考查了一定物质的量浓度溶液的配制,注意从c=n/V理解配制原理,注意碳酸钠称量应在玻璃器皿内称量.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和K2O都属于盐 | B. | H2SO4和HNO3都属于酸 | ||
| C. | KOH和Na2CO3都属于碱 | D. | Na2O和Na2SiO3都属于氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) | |
| B. | 室温下,pH=3的氢氟酸加水稀释后,溶液pH减小 | |
| C. | 室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| D. | 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | HF | Ka=6.8×10-4 mol•L-1 |
| ② | CH3COOH | Ka=1.7×10-5 mol•L-1 |
| ③ | HCN | Ka=6.2×10-10 mol•L-1 |
| ④ | H2CO3 | Ka1=4.4×10-7mol•L-1 Ka2=4.7×10-11 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
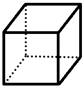 “立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图所示.
“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com