
已知:Zn(s)+ 1/2 O2(g)= ZnO(s);△H1= —351.1kJ/mol
Hg(l)+ 1/2 O2(g)= HgO(s);△H2= —90.7kJ/mol
则Zn(s)+HgO(s)= ZnO(s)+Hg(l);△H3 = ( )
A.—441.8 kJ/mol B.—254.6 kJ/mol
C.—438.9 kJ/mol D.—260.4 kJ/mol
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
有机物A是常用的食用油抗氧化剂,分子式为C10H12O5,可发生如下转化:
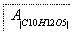
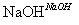
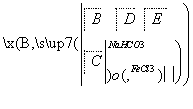
已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为
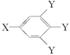 (其中:—X、—Y均为官能团)。
(其中:—X、—Y均为官能团)。
请回答下列问题:
(1)根据系统命名法,B的名称为__________。
(2)官能团—X的名称为_____________________________________,高聚物E的链节为
________________________________________________________________________。
(3)A的结构简式为______________。
(4)反应⑤的化学方程式为___________________________________________________。
(5)C有多种同分异构体,写出其中2种符合下列要求的同分异构体的结构简式________。
Ⅰ.含有苯环 Ⅱ.能发生银镜反应 Ⅲ.不能发生水解反应
(6)从分子结构上看,A具有抗氧化作用的主要原因是__________(填字母)。
a.含有苯环 b.含有羰基 c.含有酚羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
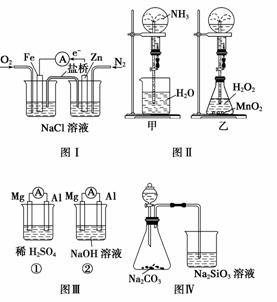
A.图Ⅰ装置中通入N2和O2的作用是相同的
B.图Ⅱ中甲、乙两装置产生喷泉的原理一样
C.图Ⅲ①装置中镁片是原电池的负极;②装置中镁片是原电池的正极
D.图Ⅳ分液漏斗中盛硝酸能证明非金属性N>C>Si,盛硫酸能证明非金属性S>C>Si
查看答案和解析>>
科目:高中化学 来源: 题型:
1g氢气燃烧生成液态水放出142.9 kJ热量,表示该反应的热化学方程式正确的是
A.2H2(g) + O2(g) = 2H2O(l) △H =-142.9 kJ/mol
B.H2(g) + 1/2O2(g) = H2O(l) △H =-285.8 kJ/mol
C.2H2 + O2 = 2 H2O △H =-571.6 kJ/mol
D.H2(g) + 1/2O2(g) = H2O(g) △H = -285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列体系加压后,对化学反应速率没有影响的是( )
A. 2SO2+O2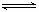 2SO3 B. CO+H2O(g)
2SO3 B. CO+H2O(g)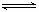 CO2+H2
CO2+H2
C. CO2+H2O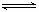 H2CO3 D. H ++ OH-
H2CO3 D. H ++ OH- H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示的是N2 + 3H22NH3 △H<0达到平衡后,改变条件建立的新平衡(图中横坐标表示反应时间, 纵坐标表示反应速率)
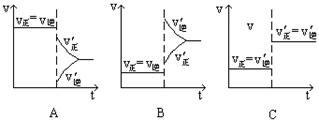
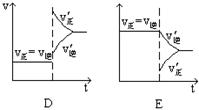
(1)表示减少H2的量而建立新平衡的是 。
(2)表示压缩气体, 体积减小而建立新平衡的是 。
(3)表示降低温度而建立新平衡的是 。
(4)表示升高温度而建立新平衡的是 。
(5)表示加入催化剂后而建立新平衡的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,生成物总能量高于反应物总能量的是
A.乙醇燃烧 B.氧化钙溶于水
C.锌粉和稀硫酸反应 D.Ba(OH)2·8H2O和NH4Cl固体反应
查看答案和解析>>
科目:高中化学 来源: 题型:
现有可逆反应m A(g)+ n B(g)  x C(g);ΔH = a kJ/mol。该反应在不同温度和压强条件下,反应物A的转化率的变化情况如图所示。下列判断正确的是
x C(g);ΔH = a kJ/mol。该反应在不同温度和压强条件下,反应物A的转化率的变化情况如图所示。下列判断正确的是
 A.a < 0,m+n < x
A.a < 0,m+n < x
B.a < 0,m+n > x
C.a > 0,m+n < x
D.a > 0,m+n > x
查看答案和解析>>
科目:高中化学 来源: 题型:
“中和热的测定”实验步骤为:
① 准备反应装置(如右图)。
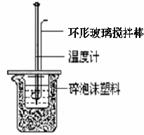
② 用一个量筒量取40 mL 0.50 mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记录。然后把温度计上的酸用水冲洗干净。
③ 用另一个量筒量取40 mL 0.55 mol/LNaOH溶液,并用温度计测量NaOH溶液的温度,记录。
④ 把温度计和_____________________放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面)。用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度。
⑤_____________________________________________________________________。
⑥ 根据实验数据计算中和热。
请回答下列问题
(1)补全第④步中所缺仪器__________________。
(2)补全第⑤步操作步骤__________________。
(3)第②步如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的ΔH__________________。(填“偏大”“偏小”或“无影响”)。
(4)近似认为0.50 mol/L盐酸0.55 mol/LNaOH溶液的密度都是1g/mL,中和后生成的溶液的比热容c=4.18J/(g·℃),起始平均温度为t1℃,反应后最高温度为t2℃,则中和热(不用化简):
ΔH=__________________。
(5)0.50L 1.00 mol/L H2SO4溶液与1.00 L 1.00 mol/L NaOH溶液完全反应,放出57.16kJ的热量,写出该中和反应的热化学方程式
__________________________________________________________________。
(6)_______(填“能”或“不能”)用稀Ba(OH)2和稀硫酸代替盐酸和NaOH溶液,理由是____________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com