
 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源:2016-2017学年河南省漯河市高二3月月考化学试卷(解析版) 题型:填空题
(7分)以环戊二烯(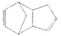 )是一种化学活性很高的烃,存在于煤焦油中。
)是一种化学活性很高的烃,存在于煤焦油中。
(1)写出双环戊二烯的分子式 ;
(2)双环戊二烯的各种同分异构体当中,可能含有的官能团有 ;
A.碳碳双键B.碳碳叁键C.苯环
(3)室温下发生下列反应: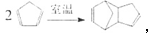 反应类型为 ;
反应类型为 ;
(4)篮烷( )是双环戊二烯的同分异构体,假设篮烷分子结构示意图中夹角只有135°、90°两种,它的一氯代物有 种。
)是双环戊二烯的同分异构体,假设篮烷分子结构示意图中夹角只有135°、90°两种,它的一氯代物有 种。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二下学期月考(一)化学试卷(解析版) 题型:填空题
X、Y、Z、W四种元素原子序数依次增大且均小于36。Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子。 回答下列问题(以下问题均以推知元素符号作答):
(1)若YX3与X2Z、YX2-与ZX-、Y3-与Z2-性质相似,请写出Mg(YX2)2在一定条件下分解的化学反应方程式_________________。
(2)已知X2Z晶胞中X2Z分子的空间排列方式与金刚石晶胞类似,相似的原因与下列因素有关的是______。
①氢键的方向性 ②氢键的饱和性 ③水中氧的杂化方式与金刚石中碳的杂化方式一样 ④晶体类型相似
(3) WZ是一种功能材料,已被广泛用于电池电极、催化剂、半导体、玻璃染色剂等方面。工业上常以W(YZ3)·6X2Z和尿素[CO(NH2)2]为原料制备。
①W2+的基态核外电子排布式为_________,其核外电子有________种运动状态。
②尿素分子中碳原子的杂化方式为_________,1mol尿素分子中含有的σ键数为______NA。
③YZ3-的空间构型________,与之互为等电子体的阴离子如________,中性分子如________;HYZ3与HYZ2 中酸性偏强的是(写化学式)__________。
④WZ晶体的结构与NaCl相同,但天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种WZ晶体中就存在如下图所示的缺陷:一个W2+空缺,另有两个W2+被两个W3+所取代。其结果晶体仍呈电中性,但化合物中W和Z的比值却发生了变化。经测定某样品中W3+与W2+的离子数之比为6:91。若该晶体的化学式为WxZ,则x=_____。
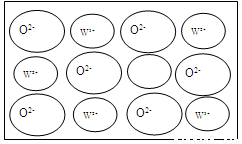
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二下学期月考(一)化学试卷(解析版) 题型:选择题
元素周期表中, 某些主族元素与右下方的主族元素的性质具相似性, 这种规律被称为“对角线规则”。 下列叙述不正确的是
A. Li在N2中燃烧生成Li3N B. Li在空气中燃烧生成Li2O2
C. 可用NaOH 溶液分离 Mg(OH)2和Be(OH)2 D. 硼酸钠溶液显碱性
查看答案和解析>>
科目:高中化学 来源:2017届河南省洛阳市高三第二次统一考试(3月)理综化学试卷(解析版) 题型:实验题
亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。
Ⅰ.经查:①Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10;②Ka(HNO2)=5.1×10-4。请设计最简单的方法鉴别NaNO2和NaCl两种固体______________________
Ⅱ. 某小组同学用如下装置(略去夹持仪器)制备亚硝酸钠

已知:①2NO+Na2O2=2NaNO2; ②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+。
(1)使用铜丝的优点是________________________。
(2)装置A中发生反应的化学方程式为_____________________________。
装置C中盛放的药品是_________;(填字母代号)
A.浓硫酸 B.NaOH溶液 C.水 D.四氯化碳
(3)该小组称取5.000g制取的样品溶于水配成250ml溶液,取25.00ml溶液于锥形瓶中,
用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③该样品中亚硝酸钠的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考化学试卷(解析版) 题型:简答题
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
(1)烟气脱硫、脱硝的环境意义是______________________;
(2)一种选择性催化脱硝(NO2)的原理为:6NO2+8NH3  7N2+12H2O
7N2+12H2O
① 上述反应中被还原的元素是_________(填元素符号),反应中每转移3mol电子,生成标准状况下N2的体积为____________;
② 超音速飞机排放的尾气是平流层中NOx的主要来源.它们破坏臭氧层的主要机理为:
Ⅰ 、O3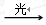 O+O2 Ⅱ 、NO+O3→NO2+O2 Ⅲ 、 NO2+O→ NO+O2
O+O2 Ⅱ 、NO+O3→NO2+O2 Ⅲ 、 NO2+O→ NO+O2
上述反应中NOx所起的作用是_____________;
(3)下表列出了2种燃煤烟气脱硫方法的原理。
方法Ⅰ | 用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 |
方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
①方法Ⅰ中用氨水吸收燃煤烟气中的SO2转化为NH4HSO3,是利用了SO2的___________性质(选填字母编号)。
A.漂白性 B.氧化性  C.还原性 D.酸性氧化物
C.还原性 D.酸性氧化物
②方法Ⅰ中氨水吸收燃煤烟气中SO2的化学反应为:2NH3+SO2+H2O=(NH4)2SO3
(NH4)2SO3+SO2+H2O=2NH4HSO3,能提高燃煤烟气中SO2去除率的措施有______(填字母).
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D.通入空气使HSO3-转化为SO42-
③采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的CO2,原因是_________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考化学试卷(解析版) 题型:选择题
下列方法中,不能用于实验室制取氨的是
A.在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热
B.加热试管中的氯化铵固体
C.将烧瓶中的浓氨水加热
D.将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三下学期第一次统测理综化学试卷(解析版) 题型:选择题
用单质铁去除酸性水体中NO3-的原理如图所示,下列说法错误的是
A. 能量转化形式主要为化学能转化为电能
B. 电极材料分别为Fe和Fe3O4
C. 负极反应为:NO3-+8e-+l0H+==NH4++3H2O
D. 该原理的总反应可表示为:NO3-+3Fe+2H++H2O= NH4+ +Fe3O4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省马鞍山市高二理科创新人才实验班招生考试化学试卷(解析版) 题型:简答题
硫的化合物种类较多,用途广泛。
I:焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一,其制备的反应原理为:Na2SO3+ SO2==Na2S2O5
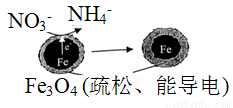
某研究小组利用下图装置制取Na2S2O5,盛硫酸的仪器叫分液漏斗。
(1)写出装置甲中发生反应的化学方程式__________________。
(2)关闭K3,要求只检查装置甲的气密性,请至少写出两种不同的操作方法。
方法1:_________________________。
方法2:_________________________。
方法3:_________________________。
(3)装置乙的作用是________________。
(4)写出焦亚硫酸钠晶体在空气中被完全氧化的化学方程式_____________。
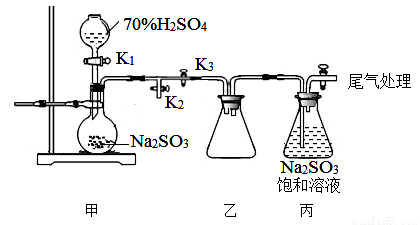
II:硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3 、FeCl2、CuCl2的混合溶液中反应用以回收S,其物质转化如图所示。
(1)反应中当有34gH2S转化为硫单质时,保持溶液中Fe3+的量不变,需要消耗O2的质量为 _____________。
(2)在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施是___________________。
(3)写出图中各步转化的化学方程式:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com