
2- 4 |
| m |
| M |
| V |
| Vm |
| m |
| M |
| m |
| M |
| 44g |
| 44g/mol |
| 4g |
| 40g/mol |
| 0.1mol |
| 0.5L |
| 9g |
| 18g/mol |


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
| A、5.6g铁与足量的盐酸反应,电子转移总数为0.3NA |
| B、将0.1mol氯化铁溶于1L水中,所得溶液中含有0.1 NA个Fe3+ |
| C、46gNO2所含原子数为3NA |
| D、1molAl放入足量的冷浓HNO3中,反应转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
t/min pH T/℃ |
3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
| 时间段 | t1~t2 | t2~t3 | t3~t4 | t5~t6 |
| 平衡常数 | K1 | K2 | K3 | K4 |
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L水含有的水分子数为NA |
| B、常温常压下,22 g CO2含有的CO2分子数为0.5NA |
| C、标准状况下,1 mol CH4分子的电子数为8 NA |
| D、物质的量浓度为1mol/L的AlCl3溶液中,Cl- 的物质的量浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
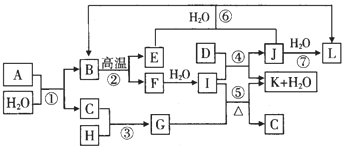
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com