
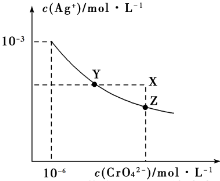
| A. | 在t℃时,Ag2CrO4的Ksp为1×10-12 | |
| B. | 在t℃时,AgCl的溶解度大于Ag2CrO4 | |
| C. | 在饱和Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点到X点 | |
| D. | 在t℃时,用AgNO3标准溶液滴定20mL未知浓度的KCl溶液,不能采用K2CrO4溶液为指示剂 |
分析 A、依据 图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,溶度积是饱和溶液中离子浓度幂次方的乘积;
B、已知t℃时AgCl的Ksp=2×10-10,由A 知Ag2CrO4的Ksp为1×10-12,则c(AgCl)=$\sqrt{Ksp}$=$\sqrt{2×1{0}^{-10}}$=1.41×10-5,而c(Ag2CrO4)=$\root{3}{\frac{Ksp}{4}}$=$\frac{\root{3}{2}}{2}$×10-4;
C、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上;
D、用AgNO3溶液滴定过程中,AgCl先沉淀出来,待AgCl定量沉淀后,过量的一滴AgNO3溶液即与K2CrO4反应,形成Ag2CrO4砖红色沉淀.
解答 解:A、依据 图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶剂平衡为:Ag2CrO4(s)?2Ag+CrO42-,
Ksp=c2(Ag+)c(CrO42-)=(10-3)2×10-6=10-12,故A正确;
B、已知t℃时AgCl的Ksp=2×10-10,由A 知Ag2CrO4的Ksp为1×10-12,则c(AgCl)=$\sqrt{Ksp}$=$\sqrt{2×1{0}^{-10}}$=1.41×10-5,而c(Ag2CrO4)=$\root{3}{\frac{Ksp}{4}}$=$\frac{\root{3}{2}}{2}$×10-4,所以在t℃时,AgCl的溶解度小于Ag2CrO4,故B错误;
C、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,故C错误;
D、用AgNO3溶液滴定过程中,由于AgCl的溶解度小,AgCl先沉淀出来,待AgCl定量沉淀后,过量的一滴AgNO3溶液即与K2CrO4反应,形成Ag2CrO4砖红色沉淀,则有砖红色沉淀生成时即达到终点,所以能采用K2CrO4溶液为指示剂,故D错误;
故选A.
点评 本题考查了沉淀溶解平衡的分析判断、溶度积常数的计算应用等,侧重于考查学生的分析能力和计算能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
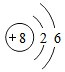 .
. ,Y的结构式为
,Y的结构式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和镁分别与冷水反应,判断钠和镁的金属性强弱 | |
| B. | 铁投入CuSO4溶液中置换出铜,判断铜与铁的金属性强弱 | |
| C. | 酸性H2CO3<HCl,判断氯与碳的非金属性强 | |
| D. | F2与Cl2分别与足量的H2反应的难易,判断氟与氯的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | O | p | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
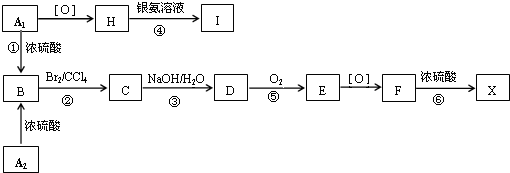
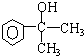 ;F
;F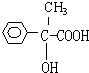 .
. ;
; .
. 、
、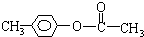 、
、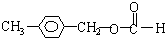 、
、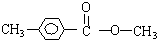 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | K+、CO32-、HS-、S2-、Al3+、AlO2- | B. | MnO4-、Na+、SO42-、K+、Cl- | ||
| C. | SO42-、Ag+、SO32-、S2-、AlO2-、K+ | D. | Fe3+、Cl-、H+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com