
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 体积/mL | 50 | 120 | 232 | 290 | 310 |
分析 (1)温度升高、浓度增大,可增大反应速率;
(2)①一段时间内收集的气体的体积越大,反应速率越大;
②根据v=$\frac{△c}{△t}$计算;
③开始反应时浓度逐渐变小,但温度逐渐升高;
(3)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变以及由此引起的一系列物理量不变.
解答 解:(1)当加热或加入浓盐酸后,反应速率明显加快,说明温度升高、浓度增大,可增大反应速率,则影响化学反应速率的因素有温度和浓度,故答案为:温度;浓度;
(2)①2~3min收集的气体的体积比其它时间段体积增大的大,则说明该时间段反应速率最大,故答案为:2~3min;
②2~3min时间段生成氢气体积为232ml-120mL=112mL,n(H2)=$\frac{0.112L}{22.4L/mol}$=0.005mol,则消耗n(HCl)=0.01mol,v=$\frac{△c}{△t}$=$\frac{\frac{0.01mol}{0.1L}}{1min}$=0.1mol.L-1.min-1,
故答案为:0.1mol.L-1.min-1;
③开始反应时浓度逐渐变小,温度逐渐升高,但反应速率逐渐增大,说明反应放热成为影响速率的主要因素,
故答案为:反应放热成为影响速率的主要因素;
(3)A.N2、H2、NH3的百分含量不再变化时,正逆反应速率相等,反应达到平衡状态,故正确;
B.反应前后气体体积之和减小,当总压强不变时,正逆反应速率相等,反应达到平衡状态,故正确;
C.N2、H2、NH3的分子数之比为1:3:2时,该反应可能达到平衡状态也可能没有达到平衡状态,与反应初始量及转化率有关,所以不能据此判断平衡状态,故错误;
D.N2、H2、NH3的浓度相等时,该反应可能达到平衡状态也可能没有达到平衡状态,与反应初始量及转化率有关,所以不能据此判断平衡状态,故错误;
E.该反应是可逆反应,达到平衡状态时正逆反应速率相等但不停止,故错误;
F.反应速率之比等于其计量数之比且反应方向相反时该反应达到平衡状态,所以v(N2)=v(H2)时一定没有达到平衡状态,故错误;
G.反应前后气体质量不变、容器体积不变,所以密度始终不变,不能根据混合气体的密度判断平衡状态,故错误;
H.混合气体的平均相对分子质量不变时,正逆反应速率相等,反应达到平衡状态,故正确;
I.正反应放出的热量等于逆反应吸收的热量时,正逆反应速率相等,反应达到平衡状态,故正确;
故答案为:A B H I.
点评 本题考查反应速率的影响因素,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握相关基础知识的积累,难度不大.


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:选择题
| A. | HAt很稳定 | B. | 易溶于某些有机溶剂 | ||
| C. | AgAt不溶于水 | D. | 是有色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | ①食醋清除水垢主要发生物理变化 ②馒头烤焦变黑主要发生化学变化 | C | ①食用加碘盐可以预防人体贫血 ②蔬菜能为人体提供多种维生素 |
| B | ①洗洁精清除油污利用了乳化作用 ②氧化钙放入水中使溶液的温度升高 | D | ①木柴架空有利于木柴的完全燃烧 ②用细沙灭火降低了可燃物着火点 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有白色沉淀生成,溶液颜色由浅绿色变棕色 | |
| B. | 有红褐色沉淀生成,上层溶液呈棕黄色 | |
| C. | 有无色无味的气体产生,该气体能使带火星的木条复燃 | |
| D. | 能看到溶液颜色加深,既无沉淀产生,也无气体放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
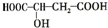 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 苹果酸在一定条件下能发生酯化反应 | |
| B. | 苹果酸在一定条件下能发生催化氧化反应 | |
| C. | 1 mol苹果酸能与3 mol的Na发生反应 | |
| D. | 1 mol苹果酸与Na2CO3溶液反应最多消耗3mol Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水 | B. | 溴水 | C. | 稀硫酸 | D. | NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com