
(1)请将N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3五种物质分别填入下面对应的横线上,组成一个未配平的化学方程式:
________+________→________+________+________+H2O
(2)反应物中发生氧化反应的物质是________,被还原的元素是________.
(3)反应中1 mol氧化剂________(填“得到”或“失去”)________mol电子.
科目:高中化学 来源: 题型:
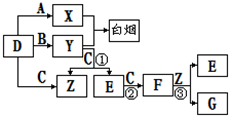 下图所示(反应条件均已略去).
下图所示(反应条件均已略去).
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
在80℃时,0.40mol的N2O4气体充入 2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20s—40s内用N2O4表示的平均反应速率为 。
(2)计算在 80℃时该反应的平衡常数K 。
(3)能判断该反应是否已达化学平衡状态的依据是________________。
a.容器中压强不变
b.混合气体中c(N2O4)不变
c.v正(NO2)=v逆(N2O4)
d.混合气体密度不变
e.混合气体的平均摩尔质量不变
f.c(N2O4)= c(NO2)
(4)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(5)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号) 。
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
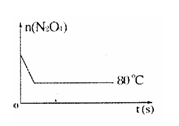
(6)如右图是 80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在 60℃时N2O4物质的量的变化曲线。
查看答案和解析>>
科目:高中化学 来源:2012届沈阳铁路实验中学高三上学期第三次月考化学试卷 题型:填空题
在80℃时,0.40mol的N2O4气体充入 2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年沈阳铁路实验中学高三上学期第三次月考化学试卷 题型:填空题
在80℃时,0.40mol的N2O4气体充入 2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算20s—40s内用N2O4表示的平均反应速率为 。
(2)计算在 80℃时该反应的平衡常数K 。
(3)能判断该反应是否已达化学平衡状态的依据是________________。
a.容器中压强不变
b.混合气体中c(N2O4)不变
c.v正(NO2)=v逆(N2O4)
d.混合气体密度不变
e.混合气体的平均摩尔质量不变
f.c(N2O4)= c(NO2)
(4)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(5)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号) 。
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(6)如右图是 80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在 60℃时N2O4物质的量的变化曲线。

查看答案和解析>>
科目:高中化学 来源: 题型:
已知pH = 2的高碘酸(H5IO6)溶液与pH = 12的NaOH溶液等体积混合,所得混合液显酸性;0.01 mol?L-1的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH = 12的NaOH溶液等体积混合,所得混合液显中性。请回答下列问题:
(1)高碘酸是 (填写“强酸”或“弱酸”),理由是___________________
。
(2)已知高碘酸和硫酸锰(MnSO4)在溶液中反应生成高锰酸,碘酸和硫酸,此反应的氧化剂是_________,高锰酸是 产物(填“氧化”或者“还原”), 高碘酸的氧化性比高锰酸要 (填“强”或者“弱”)
(3)在定量分析化学反应中各物质的计量关系时,往往可利用质量守恒、离子电荷守恒和得失电子守恒等规律将问题简单化。现有单质铁溶于稀硝酸反应的化学方程式可表示为:a Fe + b NO3- + c H+ = d Fe2+ + f Fe3+ + g NO↑+ h N2O↑+ k H2O
下列各种情况下的数学等量关系式为:
①b、c、d、f的数学关系式为_____________。
②d、f、g、h的数学关系式为_____________。
③c、g、h的数学关系式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com