
| ||
| ||
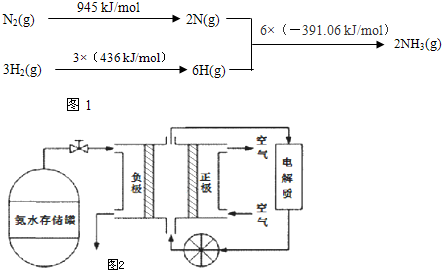
 2NH3��g����H=-93.36 kJ/mol���ʴ�Ϊ��N2��g��+3H2��g��?2NH3��g����H=-93.36 kJ/mol��
2NH3��g����H=-93.36 kJ/mol���ʴ�Ϊ��N2��g��+3H2��g��?2NH3��g����H=-93.36 kJ/mol��| 12 |
| 2��13 |
 NH3?H2O+H+SO32-+H2O
NH3?H2O+H+SO32-+H2O HSO3-+OH-��SO32-ˮ��̶ȴ���NH4+ ��ˮ��̶�ʹ��Һ��c��OH-����c��H+������Һ�ʼ��ԣ�
HSO3-+OH-��SO32-ˮ��̶ȴ���NH4+ ��ˮ��̶�ʹ��Һ��c��OH-����c��H+������Һ�ʼ��ԣ� NH3?H2O+H+SO32-+H2O
NH3?H2O+H+SO32-+H2O HSO3-+OH-��SO32-ˮ��̶ȴ���NH4+ ��ˮ��̶�ʹ��Һ��c��OH-����c��H+������Һ�ʼ��ԣ�
HSO3-+OH-��SO32-ˮ��̶ȴ���NH4+ ��ˮ��̶�ʹ��Һ��c��OH-����c��H+������Һ�ʼ��ԣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������������ȡ |
| B����ȡ���������� |
| C����������ȡ������ |
| D��������ȡ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 A��B��C��D��E��F��G��H����Է�������������������壬���Ǿ��ɶ�����Ԫ����ɣ������������ʣ�
A��B��C��D��E��F��G��H����Է�������������������壬���Ǿ��ɶ�����Ԫ����ɣ������������ʣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 һ���¶��£���2L���ܱ������з�����Ӧ��A��g��+2B��g��?xC��g����H��0��B��C�����ʵ�����ʱ��仯�Ĺ�ϵ��ͼ�������й�˵������ȷ���ǣ�������
һ���¶��£���2L���ܱ������з�����Ӧ��A��g��+2B��g��?xC��g����H��0��B��C�����ʵ�����ʱ��仯�Ĺ�ϵ��ͼ�������й�˵������ȷ���ǣ�������| A��x=2 |
| B����Ӧ��ʼ2 min�ڣ�v��B��=0.1 mol?L-1?min-1 |
| C��2 min�����¶�ƽ�������ƶ� |
| D��ʹ�ô������Լӿ췴Ӧ���ʣ���B��ת���ʲ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����Ϸ�Ӧ���ɷ��� |
| B��ֻ�Т��ܷ��� |
| C��ֻ�Т߲��ܷ��� |
| D��ֻ�Тڲ��ܷ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2-��-3-������ |
| B��2-���� |
| C��2��2-����-1-�ȶ��� |
| D��1��3-���ȱ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com