
【题目】下列叙述正确的是( )
A. 已知2H2(g)+O2(g)=2H2O(g) ΔH=-480.4kJ/mol ,则H2的燃烧热为ΔH=-240.2kJ/mol
B. 已知N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.0kJ/mol,则将1molN2(g))和3molH2(g)置于一密闭容器中充分反应后放出的热量小于92.0kJ
2NH3(g)ΔH=-92.0kJ/mol,则将1molN2(g))和3molH2(g)置于一密闭容器中充分反应后放出的热量小于92.0kJ
C. 已知甲烷氧化:CH4(g)+O2(g)=CO2(g) +2H2(g)ΔH=-322.0kJ/mol,则反应物的键能总和大于生成物的键能总和
D. 测量中和热的实验时,应选用的试剂为50ml 0.5mol/L的盐酸与50ml 0.5mol/L的NaOH溶液
【答案】B
【解析】
A、H2的燃烧热要用水是液态时的ΔH;
B、N2(g)+3H2(g)![]() 2NH3(g)反应是可逆反应,则将1molN2(g))和3molH2(g)置于一密闭容器中充分反应后放出的热量小于92.0kJ;
2NH3(g)反应是可逆反应,则将1molN2(g))和3molH2(g)置于一密闭容器中充分反应后放出的热量小于92.0kJ;
C、焓变为负,焓变等于断裂化学键的键能之和减去成键的键能之和;
A、H2的燃烧热要用水是液态时的ΔH,故A错误;
B、N2(g)+3H2(g)![]() 2NH3(g)反应是可逆反应,则将1molN2(g))和3molH2(g)置于一密闭容器中充分反应后放出的热量小于92.0kJ,故B正确;
2NH3(g)反应是可逆反应,则将1molN2(g))和3molH2(g)置于一密闭容器中充分反应后放出的热量小于92.0kJ,故B正确;
C、焓变为负,焓变等于断裂化学键的键能之和减去成键的键能之和,焓变为负,可知反应物的键能总和小于生成物的键能总和,故C错误;
D、测量中和热的实验时,应让一种试剂过量,应选用的试剂为50ml 0.5mol/L的盐酸与55ml 0.5mol/L的NaOH溶液,或:55ml 0.5mol/L的盐酸与50ml 0.5mol/L的NaOH溶液,故D错误;
故选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。请回答下列问题:
(1)C在元素周期表中的位置为_____________,G的原子结构示意图是__________________________。
(2)D与E按原子个数比1:1形成化合物甲,其电子式为_________,所含化学键类型为___________,向甲中滴加足量水时发生反应的化学方程式是____________________________。
(3)E、F、G三种元素形成的简单离子,半径由大到小的顺序是__________。(用离子符号表示)
(4)用BA4、D2和EDA的水溶液组成燃料电池,电极材料为多孔惰性金属电极。在a极通入BA4气体,b极通入D2气体,则a极是该电池的________极,正极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑩10种元素在周期表中的位置。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑤ | ⑥ | ⑩ | |||||
3 | ① | ③ | ④ | ⑦ | ⑧ | |||
4 | ② | ⑨ |
(1)上述元素中,最不活泼的是(填元素符号,下同)________,金属性最强的是________,③④⑤三种元素的原子半径由大到小的顺序是________。
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是________(填化学式,下同),呈两性的氢氧化物是________。
(4)比较⑥和⑦氢化物的稳定性由强到弱的顺序是_______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列
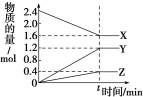
表述中正确的是
A.反应的化学方程式为2X = 3Y + Z
B.t时,正、逆反应都不再继续进行,反应达到化学平衡
C.若t=4,则0~t的X的化学反应速率为0.1 molL-1min-1
D.温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关问题,与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂③草木灰与铵态氮肥不能混合施用④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞⑤加热蒸干AlCl3溶液得到Al2O3固体
A. ①②③ B. ②③④⑤ C. ②③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电解质溶液的浓度对电极电势的影响,可设计浓差电池。下图为一套浓差电池和电解质溶液再生的配套装置示意图,闭合开关K之前,两个Cu电极的质量相等。下列有关这套装置的说法中错误的是

A.甲池中的电极反应式为![]()
B.电解质溶液再生池内发生的只是物理变化,循环物质E为水
C.乙池中Cu电极电势比甲池中Cu电极电势低
D.若阴离子交换膜处迁移的![]() 的物质的量为1mol,两电极的质量差为64g
的物质的量为1mol,两电极的质量差为64g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe3O4的混合物中加入100mL2mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( )
A. 11.2gB. 5.6gC. 2.8gD. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 1.4gC2H4、C3H6 的混合气体中,所含碳原子总数为 0. lNA
B. 1.0 mol CH4 与 Cl2 在光照下反应生成的 CH3Cl 分子数为 1.0NA
C. 标准状况下,22. 4LC2H6 中所含极性共价键的数目为 7NA
D. 50mL l2mol·L 的浓盐酸与足量 MnO2 反应,转移电子总数为 0. 3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx是空气的主要污染物之一。回答下列问题:
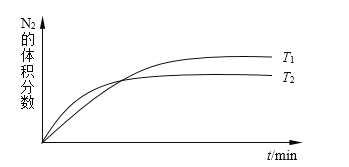
(1)汽车尾气中的NO来自于反应:N2(g)+ O2(g)![]() 2NO(g)。如图表示在不同温度时,一定量NO分解过程中N2的体积分数随时间的变化。则N2(g)+ O2(g)
2NO(g)。如图表示在不同温度时,一定量NO分解过程中N2的体积分数随时间的变化。则N2(g)+ O2(g)![]() 2NO(g)为________(填“吸热”或“放热”)反应。2000℃时,向容积为2L的密闭容器中充入10mol N2和5mol O2,发生上述反应,10min达到平衡,产生2mol NO,则10min内的平均反应速率υ(O2)=____mol·L-1·min-1。
2NO(g)为________(填“吸热”或“放热”)反应。2000℃时,向容积为2L的密闭容器中充入10mol N2和5mol O2,发生上述反应,10min达到平衡,产生2mol NO,则10min内的平均反应速率υ(O2)=____mol·L-1·min-1。
(2)在汽车的排气管上加装催化转化装置可减少NOx的排放。研究表明,NOx的脱除率除与还原剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以La0.8A0.2BCoO3+X(A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:
第一阶段:B4+(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:NO(g)+□→NO(a) ΔH1、K1
2NO(a)→2N(a)+O2(g) ΔH2、K2
2N(a)→N2(g)+2□ ΔH3、K3
2NO(a)→N2(g)+2O(a) ΔH4、K4
2O(a)→O2(g)+2□ ΔH5、K5
注:□表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原B4+得到低价态的金属离子越多,第二阶段反应的速率越快,原因是_____。第二阶段中各反应焓变间的关系:2ΔH1+ΔH2+ΔH3=________;该温度下,NO脱除反应2NO(g)![]() N2(g)+O2(g)的平衡常数K=_______(用K1、K2、K3的表达式表示)。
N2(g)+O2(g)的平衡常数K=_______(用K1、K2、K3的表达式表示)。
(3)工业废气中的NO和NO2可用NaOH溶液吸收。向20mL0.1mo1·L-1NaOH溶液中通入含NO和NO2的废气,溶液pH随气体体积V的变化如图1所示(过程中温度保持不变),B点对应的溶液中c(HNO2)=c(NO2-),则A点对应溶液中c(NO2-)/c(HNO2)=________。
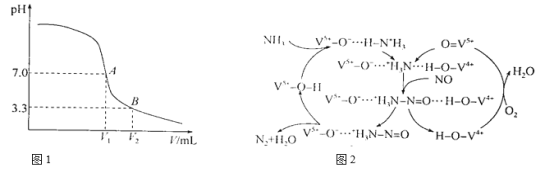
(4)氨催化还原法也可以消除NO,原理如图2所示,NO最终转化为H2O和________(填电子式);当消耗1 molNH3和0.5 molO2时,理论上可消除____________L(标准状况)NO。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com