
(10分)为测定某种胃药中CaCO3含量,化学兴趣小组同学设计了以下两种方案(药片 中的其它成分与盐酸和NaOH均不反应,请回答有关问题:
中的其它成分与盐酸和NaOH均不反应,请回答有关问题:
(1)方案一:用右侧装置测量一定量样品与足量稀盐酸反应生成CO2的体积计算CaCO3的含量;装置中连通管X的作用是 。
(2)方案二:用滴定法测定,有以下几步操作:
A.配制0.1mol/LHC1溶液和0.100 mol/LNaOH溶液
B.取一粒药片(0. 100g),研碎后加入20mL蒸馏水
C.以酚酞为指示剂,用0.100 mol/LNaOH溶液滴定,用去体积为VmL达到终点
D.用酸式滴定管加入25ml 0.1mol/LHC1溶液,充分反应
 ①滴定过程的正确操作顺序为 (填字母)。
①滴定过程的正确操作顺序为 (填字母)。
滴定终点的判断依据是 。
②若需重复滴定4次,配制0.1mol/LHC1溶液需选用右图所示仪器中的 (填字母)。
③经测定,每次消耗NaOH溶液体积的平均值为13.00ml,则该胃药中CaCO3的质量分数为 ,
④与方案一相比,方案二的主要优点是:除了滴定法所需样品和试剂量少之外,还有 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
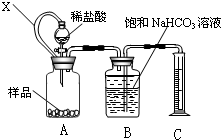 某种胃药中抗酸剂为CaCO3.甲、乙两同学为测定其中CaCO3含量,分别设计以下两种方案(药片中的其它成分与HCl和NaOH溶液均不反应).请回答下列有关问题:
某种胃药中抗酸剂为CaCO3.甲、乙两同学为测定其中CaCO3含量,分别设计以下两种方案(药片中的其它成分与HCl和NaOH溶液均不反应).请回答下列有关问题:查看答案和解析>>
科目:高中化学 来源:枣庄市二OO七届高三第一次调研考试、化学试题 题型:022
| |||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
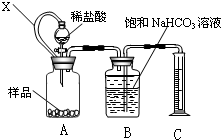 某种胃药中抗酸剂为CaCO3.甲、乙两同学为测定其中CaCO3含量,分别设计以下两种方案(药片中的其它成分与HCl和NaOH溶液均不反应).请回答下列有关问题:
某种胃药中抗酸剂为CaCO3.甲、乙两同学为测定其中CaCO3含量,分别设计以下两种方案(药片中的其它成分与HCl和NaOH溶液均不反应).请回答下列有关问题:查看答案和解析>>
科目:高中化学 来源:2009-2010学年江苏省扬州市高二(上)期末化学试卷(必修)(解析版) 题型:解答题
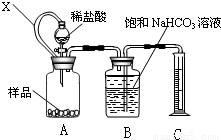
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com