
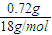 =0.04mol,2H2O=2H2↑+O2↑,生成的氧气为0.02mol,生成氢气物质的量为0.04mol,阳极电极反应是氯离子和氢氧根离子放电生成氯气和氧气,2Cl--2e-=Cl2↑,生成氯气物质的量为0.08mol,阳极生成的气体物质的量为0.12mol;标准状况体积为0.12mol×22.4L/mol=2.688L,故B错误;
=0.04mol,2H2O=2H2↑+O2↑,生成的氧气为0.02mol,生成氢气物质的量为0.04mol,阳极电极反应是氯离子和氢氧根离子放电生成氯气和氧气,2Cl--2e-=Cl2↑,生成氯气物质的量为0.08mol,阳极生成的气体物质的量为0.12mol;标准状况体积为0.12mol×22.4L/mol=2.688L,故B错误;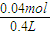 0.1mol/L,PH=1,故D正确;
0.1mol/L,PH=1,故D正确;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 现用该蓄电池电解c(NO3-)=6mol?L-1的KNO3和Cu(NO3)2的混合溶液500mL,当通电一段时间后,两极均收集到22.4L气体(标准状况)(电解池的电极均为石墨电极).
现用该蓄电池电解c(NO3-)=6mol?L-1的KNO3和Cu(NO3)2的混合溶液500mL,当通电一段时间后,两极均收集到22.4L气体(标准状况)(电解池的电极均为石墨电极).查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 | 放电 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com