
| A. | Na+、Fe2+、NO3- | B. | K+、ClO-、SO42- | ||
| C. | NH4+、HCO3-、AlO2- | D. | Cu2+、Mg2+、Cl- |
分析 酸性溶液中含大量的H+,根据离子之间不能结合生成水、气体、沉淀、弱电解质等,或不发生氧化还原反应,则离子能大量共存,以此解答该题.
解答 解:A.酸性条件下Fe2+、NO3-发生氧化还原反应而不能大量共存,故A错误;
B.酸性条件下ClO-不能大量共存,故B错误;
C.酸性条件下HCO3-、AlO2-不能大量共存,故C错误;
D.酸性条件下,离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评 本题考查离子的共存问题,为高考常见题型,侧重于元素化合物知识的综合理解和运用的考查,明确信息及其应用、复分解反应发生的条件、离子之间的氧化还原反应是解答本题的关键,题目难度中等.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | 放电时,CH3OH参与反应的电极为正极 | |
| B. | 放电时,每通入标况下11.2L O2完全反应转移电子数为1mol | |
| C. | 放电时,电解质溶液的pH逐渐增大 | |
| D. | 放电时,负极反应为:CH3OH-6e-+8OH-=CO32-+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
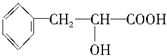
 (只要求写出一个化学方程式,有机物写结构简式).
(只要求写出一个化学方程式,有机物写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体颜色不再变化 | |
| B. | 单位时间内生成nmol氢气的同时生成nmol碘蒸气 | |
| C. | 若该反应在隔热密闭体积恒定的容器中进行反应,体系的温度不再变化 | |
| D. | 2v正(H2)=v逆(HI) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
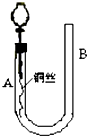 为了说明稀硝酸与铜反应产生无色的一氧化氮气体,某同学设计了如图所示的实验装置.实验时,将分液漏斗的活塞打开,从U形管的长管口B注入稀硝酸,一直到U形管的短管口A单孔塞下沿且液面不再留有气泡为止.关闭活塞,并用酒精灯在U形管短管下微热.当铜丝上有气泡产生时,立即撤去酒精灯.试回答:
为了说明稀硝酸与铜反应产生无色的一氧化氮气体,某同学设计了如图所示的实验装置.实验时,将分液漏斗的活塞打开,从U形管的长管口B注入稀硝酸,一直到U形管的短管口A单孔塞下沿且液面不再留有气泡为止.关闭活塞,并用酒精灯在U形管短管下微热.当铜丝上有气泡产生时,立即撤去酒精灯.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
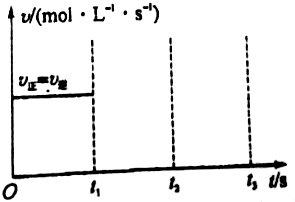 工业上制硫酸的第二步反应:2SO2(g)+O2(g)?2SO3(g)△H<0,在一定条件下通入2mol SO2(g)和1mol O2(g)达到平衡时,其反应速率关系如图所示.维持温度、压强不变,在t1时刻充入2mol SO3(g),t2时反应达到新的平衡.请画出t1~t3正、逆反应速率v正、v逆的变化示意图.
工业上制硫酸的第二步反应:2SO2(g)+O2(g)?2SO3(g)△H<0,在一定条件下通入2mol SO2(g)和1mol O2(g)达到平衡时,其反应速率关系如图所示.维持温度、压强不变,在t1时刻充入2mol SO3(g),t2时反应达到新的平衡.请画出t1~t3正、逆反应速率v正、v逆的变化示意图.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
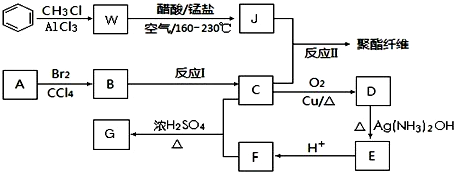
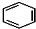 +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$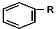 +HCl(-R为烃基)
+HCl(-R为烃基)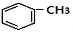 $→_{空气/160-230℃}^{醋酸/锰盐}$
$→_{空气/160-230℃}^{醋酸/锰盐}$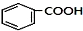
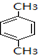 .
.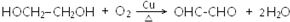 .
.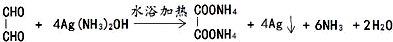 .
.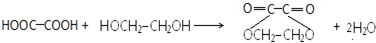 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
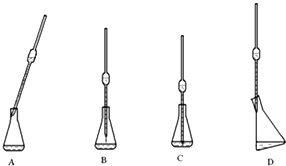 利用所学化学知识解答问题:
利用所学化学知识解答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com