
| A. | 用石灰、碳酸钠等碱性物质处理废水中的酸 | |
| B. | 用可溶性的铝盐和铁盐处理水中的悬浮物 | |
| C. | 用氯气处理水中的Cu2+、Hg2+等重金属离子 | |
| D. | 用烧碱处理含高浓度NH4+的废水并回收利用氨 |
分析 A.石灰、碳酸钠都可与酸反应;
B.可溶性的铝盐和铁盐可水解生成具有吸附性的胶体;
C.氯气不能与Cu2+、Hg2+反应生成沉淀;
D.烧碱可与铵根离子反应生成氨气.
解答 解:A.石灰与酸反应生成钙盐,碳酸钠与酸反应生成钠盐和二氧化碳,故可用于处理废水中的酸,故A正确;
B.铝盐、铁盐都能水解生成对应的氢氧化物胶体,疏松多孔,具有吸附性,可吸附水中的悬浮物,故B正确;
C.氯气可用于水的消毒杀菌,不能与Cu2+、Hg2+反应生成沉淀,对重金属离子没有作用,故C错误;
D.烧碱可与铵根离子反应产生氨气,则可用烧碱处理高浓度的NH4+的废水并回收利用氨,故D正确.
故选C.
点评 本题考查废水的处理,为2017年天津考题,侧重于化学与生活、生产的考查,有利于培养学生的良好的科学素养,注意把握物质的性质,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 玛瑙、水晶、钻石、红宝石等装饰品的主要成分都是硅酸盐 | |
| B. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 | |
| C. | “山东疫苗案”涉及疫苗未冷藏储运而失效,这与蛋白质变性有关 | |
| D. | 沼气是可再生资源,电能是二次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,足量Fe与22.4 L Cl2反应,转移的电子数为2NA | |
| B. | 0.1molO2完全反应时,转移的电子数一定为 0.4 NA | |
| C. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为 0.2NA | |
| D. | 常温常压下,100 g 17% H2O2水溶液中含氧原子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
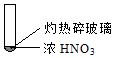 | 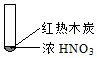 | 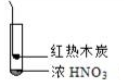 |
| ① | ② | ③ |
| A. | 由①中的红棕色气体,推断产生的气体一定是混合气体 | |
| B. | 红棕色气体不能表明②中木炭与浓硝酸产生了反应 | |
| C. | 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物 | |
| D. | ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
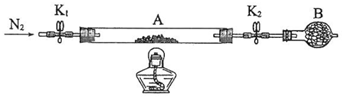
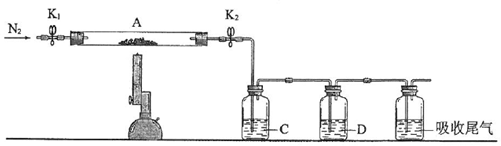
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加c(CO),平衡向正向移动,反应的平衡常数增大 | |
| B. | 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃ | |
| C. | 第二阶段,Ni(CO)4分解率较低 | |
| D. | 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
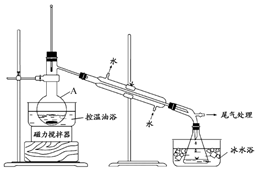 1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g•cm-3.实验室制备少量1-溴丙烷的主要步骤如下:
1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g•cm-3.实验室制备少量1-溴丙烷的主要步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com