
 DIDP常温下为液体,工业上常用作树脂或塑料增塑剂,密度约为0.966g•cm-3,不溶于水,易溶于有机溶剂,制备邻苯二甲酸二异癸酯(DIDP)的主要操作步骤如下(夹持和加热装置已略去):
DIDP常温下为液体,工业上常用作树脂或塑料增塑剂,密度约为0.966g•cm-3,不溶于水,易溶于有机溶剂,制备邻苯二甲酸二异癸酯(DIDP)的主要操作步骤如下(夹持和加热装置已略去): )、95.7g异癸醇及邻苯二甲酸酐;
)、95.7g异癸醇及邻苯二甲酸酐;分析 (1)依据反应过程分析,酯化反应需要催化剂判断;
(2)步骤②中,升温至210℃,持续搅拌反应3h的目的是使反应充分反应,当分水器中水液面不变时什么反应完成;
(3)依据抽滤装置分析需要的硅酸盐质仪器;
(4)分液操作风险,下层从下层放出;
(5)减压蒸馏的目的是防止高温下发生副反应;
解答 解:(1)邻苯二甲酸酐和异癸醇发生酯化反应,需要钛酸四异丙酯做催化剂,实验钛酸四异丙酯的作用是催化剂的作用;
故答案为:催化剂;
(2)步骤③中搅拌下保温的目的是使反应充分进行,当分水器中的水不再增加时,反应结束;
故答案为:使反应充分进行;分水器中的水不再增加;
(3)抽滤时,用到的硅酸盐质仪器为玻璃仪器主要有布氏漏斗,吸滤瓶;
故答案为:布氏漏斗、吸滤瓶;
(4)邻苯二甲酸二异癸酯为无色粘稠液体,密度约为0.966g•cm-3,不溶于水,步骤④中分液时,得到粗产品的实验操作为从分液漏斗下端放出粗产品于烧杯中;
故答案为:从分液漏斗下端放出粗产品于烧杯中;
(5)工艺流程中减压蒸馏的目的是降低沸点,防止高温下发生副反应,致使产品不纯;
故答案为:降低沸点,防止高温下发生副反应,致使产品不纯.
点评 本题考查了物质制备实验过程分析判断,实验仪器和基本操作的掌握是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
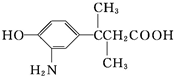 ),下列关于A的叙述中错误的是( )
),下列关于A的叙述中错误的是( )| A. | 该物质在一定条件下能发生缩聚反应 | |
| B. | 该物质的核磁共振氢谱(1H-NMR)上共有7个峰 | |
| C. | 1 mol该物质最多能与含1 mol Br2的溴水发生取代反应 | |
| D. | 该物质能与Na、NaOH、NaHCO3、盐酸等物质反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30mL | B. | 25mL | C. | 20mL | D. | 0mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 相关物质 | 相关说法 |
| A | 1mol CH3COONa和少量CH3COOH溶于水所得的中性溶液中 | CH3COO-数目为NA |
| B | Na2O和Na2O2的混合物共1mol | 阴离子数目可能为1.5NA |
| C | 向含2mol H2SO4的浓硫酸中加入足量的Zn粉,加热充分反应 | 转移的电子数为2NA |
| D | 3.0g由淀粉和葡萄糖组成的混合物中 | 所含的碳原子数为0.1NA |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入10 mL蒸馏水后,CH3COO-的数目减少,c(OH-)增大 | |
| B. | 加入V mL 0.1 mol•L-1 NaOH溶液后,若c(Na+)=c(CH3COO-),则V=10 | |
| C. | 加入10 mL 0.1 mol•L-1NH3•H2O溶液后,溶液中存在:c(CH3COO-)+c(CH3COOH)=c(H+)+c(N${H}_{4}^{+}$) | |
| D. | 将其逐滴加入10 mL 0.1 mol•L-1Na2CO3溶液中,混合溶液中存在:c(H+)+c(CH3COOH)+c(H2CO3)=c(OH-)+c(C${O}_{3}^{2-}$) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①② | B. | ①③ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com