
以下是对某水溶液进行离子检验的方法和结论,其中正确的是
A.先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀。溶液中一定含有大量的SO42-
B.加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定有大量的CO32-
C.用洁净的铂丝蘸取该溶液,置于火焰上灼烧,透过蓝色钴玻璃能观察到火焰呈紫色。该溶液中一定含有钾离子,可能含有钠离子。
D.先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀。溶液中一定含有大量的Cl-
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮氧化物(含NO、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O、NO+NO2+2NaOH=2NaNO2 +H2O。则生成的盐溶液中NaNO3的物质的量为
+H2O。则生成的盐溶液中NaNO3的物质的量为
A. 0.2 mol B. 0.4 mol C. 0.6 mol D. 0.8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制备1,2二溴乙烷的反应原理如下:
CH3CH2OH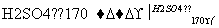 CH2===CH2
CH2===CH2
CH2===CH2+Br2—→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140 ℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:
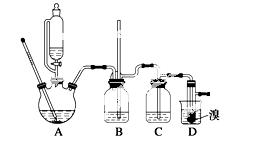
有关数据列表如下:
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是________;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置 C中应加入________,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
C中应加入________,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是___________________________;
(4)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在______层(填“上”或“下”);
(5)若产物中有少量未反应的Br2,最好用________洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液
c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用__________的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是___________________;但又不能过度冷却(如用冰水),其原因是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活是紧密相联的,下列说法正确的是
A.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰
B.海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化
C.为了增强漂白粉的使用效果,在使用漂白粉时必须和盐酸混合使用
D.今年春天,在我国南方发生了不同程度的旱情,缓解旱情的措施之一是可以用干冰或碘化银进行人工降雨
查看答案和解析>>
科目:高中化学 来源: 题型:
若NA表示阿伏加德罗常数,下列说法正确的是
A、在标准状况下,NA个水分子所占的体积约为22.4L
B、5.6g铁与氯气完全反应,失去电子的数目为0.2NA
C、1 mol C12发生化学反应,转移的电子数必为2NA
D、在标准状况下,22.4L由N2、N2O组成的混合气体中所含有的氮原子的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其它铁的化合物。某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了以下探究:
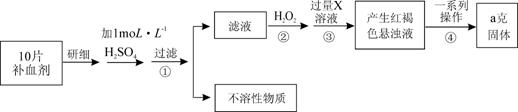 |
请回答下列问题:
Ⅰ.(1)实验时用18.4 mol·L-1的浓硫酸,配制100 mL 1 mol·L-1 H2SO4溶液,所需浓硫酸的体积为 。(计算结果精确到小数点后一位)
(2)下列操作中,容量瓶所具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液
C.用来溶解固体溶质 D.常用来代替量筒量取一定体积的液体
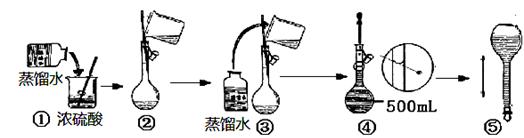 (3)在下列配制过程示意图中,有错误的是(填写序号) 。
(3)在下列配制过程示意图中,有错误的是(填写序号) 。
 | |||||
| |||||
|
(4)下列说法正确的
A.洗涤烧杯2~3次,并将洗涤液移入容量瓶以减少误差
B.某同学将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低
C.定容时仰视观察, 所配溶液浓度会偏低
D.容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液即可
Ⅱ.(1)步骤②加入过量H2O2的目的: 。
(2)从红褐色的悬浊液到最后的称量,其过程中所需的基本操作为:
a. ,b. 洗涤,c. 灼烧,d. 冷却
(3)若称得固体的质量为ag,则每片补血剂中含硫酸亚铁的质量为 。
Ⅲ.已知人体不能很好地吸收利用Fe3+,科学研究表明服用含硫酸亚铁的补血剂时,同时服用维生素C,以利于铁元素的吸收。试分析维生素C在这一过程中的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
一容器中X元素构成的气态单质X2分子有3种,相对分子质量分别为32、34、36.又知容器中3种分子数之比为15:4:1.由此可以确定的是( )
|
| A. | 若容器中X2全部转化为它的同素异形体X3,那么X3的分子量有3种 |
|
| B. | 质量数为16的一种核素在此容器中的原子百分数为85% |
|
| C. | 只要容器中同位素组成不变,X原子在任何条件下发生重新组合,最后得到三种 X2,分子数之比总是15:4:1 |
|
| D. | 此容器中X2的平均分子量是34 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断正确的是( )
|
| A. | 与NaOH反应的氯气一定为0.3 mol |
|
| B. | n(Na+):n(Cl﹣)可能为7:3 |
|
| C. | 若反应中转移的电子为n mol,则0.15<n<0.25 |
|
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液,只要用试管和胶头滴管,不用任何试剂就 可以鉴别的是 ( )
可以鉴别的是 ( )
A.KO H溶液和Al2(SO4)3溶液
H溶液和Al2(SO4)3溶液
B.稀H2SO4和NaHCO3溶液
C.CaCl2溶液和Na2CO3溶液
D.Ba(OH)2溶液和NaHSO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com