
| A. | 具有相同质子数的微粒一定属于同一种元素 | |
| B. | H2O和H2O2互为同素异形体 | |
| C. | 含有金属元素的离子不一定是阳离子 | |
| D. | 同种元素的原子中,中子数和质子数一定都相同 |
分析 A.纯净物是由一种物质组成的物质;
B.同素异形体是指由同种元素组成的不同单质;
C.含有金属元素的离子不一定是阳离子,可能是阴离子;
D.根据元素是具有相同核电荷数同一类原子的总称.
解答 解:A.具有相同质子数的微粒不一定属于同一种元素,例如,钠原子与铵根离子的质子数都是11,不属于同一种元素,故A错误;
B.H2O和H2O2是化合物,不属于同素异形体,故B错误;
C.含有金属元素的离子不一定是阳离子,如AlO2-等,故C正确;
D.同种元素的原子中,质子数一定相同,中子数不一定相同,故D错误.
故选C.
点评 本题考查了元素、同素异形体等概念,题目难度不大,明确相关概念是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | c1=2c2 | B. | c1>c2 | C. | c1=c2 | D. | c1<c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
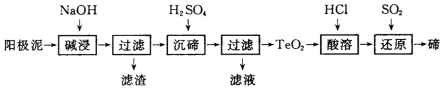
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
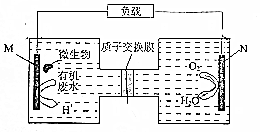 微生物电池是指在微生物的作用下将化学能转化为电能的装置,如图是利用一种微生物将有机废水中的尿素[CO(NH2)3]转化为对环境无害物质的装置.下列叙述错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,如图是利用一种微生物将有机废水中的尿素[CO(NH2)3]转化为对环境无害物质的装置.下列叙述错误的是( )| A. | M电极有CO2和N2生成 | B. | H+透过质子交换膜由左向右移动 | ||
| C. | 微生物促进了反应中电子的转移 | D. | N电极反应式为:O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子结构示意图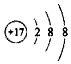 ,可以表示35Cl-,也可以表示37Cl- ,可以表示35Cl-,也可以表示37Cl- | |
| B. | 电子式 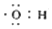 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| C. | 比例模型 可以表示甲烷分子,也可以表示四氯化碳分子 可以表示甲烷分子,也可以表示四氯化碳分子 | |
| D. | 聚丙烯的结构简式为: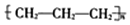 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
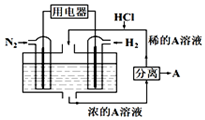 有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,制造出新型燃料电池,装置如图所示,下列有关说法正确的是( )
有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,制造出新型燃料电池,装置如图所示,下列有关说法正确的是( )| A. | 通入N2的一极为负极 | |
| B. | 通入H2的电极反应为:H2+2e-=2H+ | |
| C. | 物质A是NH4Cl | |
| D. | 反应过程中左边区域溶液pH逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com