
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014学年四川省资阳市4月高考模拟考试理综化学试卷(解析版) 题型:实验题
Ⅰ、某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3,乙同学认为沉淀是CuCO3和Cu(OH)2的混合物。他们设计实验通过测定沉淀中CuCO3的质量分数来确定沉淀的组成。
(1)按照甲同学的观点,发生反应的离子方程式为: 。
(2)两同学利用下图所示装置进行测定:
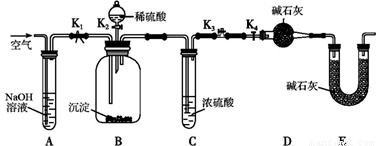
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为_____、_____、干燥。
②装置E中碱石灰的作用是 。
③实验过程中有以下操作步骤:
a.关闭K2、K4,打开K1、K3,通入过量空气
b.关闭K1、K3,打开K2、K4,充分反应
c.关闭K2、K3,打开K1、K4,通入过量空气
若沉淀质量为m,C中浓硫酸增重x,D中碱石灰增重为y,则CuCO3的质量分数为______。若未进行步骤a,将使测量结果 。
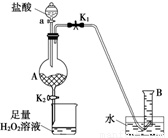
Ⅱ、某同学设计右图所示装置(夹持装置略,气密性已检验),用废铁屑来制取FeCl3·6H2O晶体。其操作步骤如下:
①打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸至过量。
②当……时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
③将烧杯中含有盐酸的溶液蒸发浓缩、冷却结晶、过滤后得到FeCl3·6H2O晶体。
请回答:
(1)步骤②中“……”的内容是_____。
(2)写出A中溶液进入烧杯后发生反应的离子方程式:____。
(3)步骤③烧杯中溶液里盐酸的作用是____。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省宁德市毕业班质量检查(理综)化学部分 题型:选择题
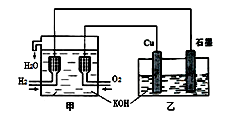
利用右图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑。下列说法正确的是
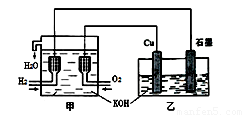
A. 乙中Cu电极的电极反应式是:
2Cu + 2OH-→ Cu2O+ H2O + 2e-
B. 甲中通入氢气的电极为正极
C. 乙中阴离子向石墨电极移动
D. 电路上通过0.5 mol电子,可制得0.5 mol Cu2O
查看答案和解析>>
科目:高中化学 来源: 题型:
利用右图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑。下列说法正确的是
A. 乙中Cu电极的电极反应式是:
2Cu + 2OH-→ Cu2O+ H2O + 2e-
B. 甲中通入氢气的电极为正极
C. 乙中阴离子向石墨电极移动
D. 电路上通过0.5 mol电子,可制得0.5 mol Cu2O
查看答案和解析>>
科目:高中化学 来源:2011届福建省宁德市高三普通高中毕业班质量检查(理综)化学部分 题型:单选题
利用右图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑。下列说法正确的是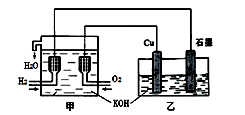
| A.乙中Cu电极的电极反应式是: 2Cu + 2OH-→ Cu2O+ H2O+ 2e- |
| B.甲中通入氢气的电极为正极 |
| C.乙中阴离子向石墨电极移动 |
| D.电路上通过0.5 mol电子,可制得0.5 mol Cu2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com