
分析 Al表面的氧化膜为氧化铝,氧化铝为两性氧化物,与氢氧化钠溶液反应生成偏铝酸钠和水;酸性K2Cr2O7溶液具有强氧化性,能够将铝氧化成氧化铝,溶液最终变为绿色,反应后K2Cr2O7被还原成生成Cr3+离子,
解答 解:用浓氢氧化钠清洗铝材,氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,然后将铝材放入硫酸酸化的重铬酸钾溶液中,50s即可形成氧化膜,溶液最终变为绿色,说明铝表面被氧化成氧化铝,重铬酸根离子被还原成Cr3+,反应的离子方程式为:Cr2O72-+2Al+8H+=2Cr3++4H2O+Al2O3;
用电解的方法,以稀硫酸为电解质溶液,铝为阳极,阳极上铝失电子和水反应生成氧化铝和氢离子,电极反应式为:2Al+3H2O-6e-=Al2O3+6H+,
故答案为:Al2O3+2OH-=2AlO2-+H2O;Cr2O72-+2Al+8H+=2Cr3++4H2O+Al2O3;阳;2Al+3H2O-6e-=Al2O3+6H+.
点评 本题考查了离子方程式、电极反应式的书写,题目难度中等,明确发生反应实质为解答关键,注意掌握原电池工作原理,试题培养了学生的分析、理解能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
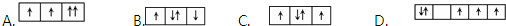
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径大小顺序:rX>rY>rZ | |
| B. | W的单质和水反应生成两种强电解质 | |
| C. | Y、Z的单质均可通过电解制得 | |
| D. | X的气态氢化物的热稳定性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 草酸 | 碳酸 | |
| 一级电离常数(Kad) | 5.9×10-2 | 4.2×10-7 |
| 二级电离常数(Kad) | 6.4×10-3 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔质量g• | B. | 气体摩尔体积mol•L-1 | ||
| C. | 物质的量•mol-1 | D. | 物质的量浓度:mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
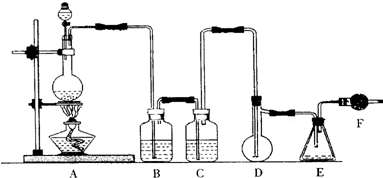
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
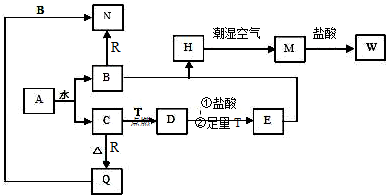
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| B. | KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O | |
| D. | 硫酸亚铁加过氧化氢溶液:Fe2++H2O2+2H+=Fe3++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com