
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验现象 | 实验结论 |
| A | 将铝片分别投入浓、稀硝酸中,前者无明显现象,后者反应剧烈 | 稀硝酸的氧化性比浓硝酸的强 |
| B | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色变浅 | Na2CO3溶液中存在水解平衡 |
| C | 某溶液中滴加过量氨水产生白色沉淀且不溶解 | 该溶液中一定含有Mg2+ |
| D | 溴水中通入SO2,溴水褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎将酸液溅到眼中,应立即用大量水冲洗,边洗边眨眼睛 | |
| B. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| C. | 洒在桌面上的酒精燃烧,立即用湿抹布盖灭 | |
| D. | 进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
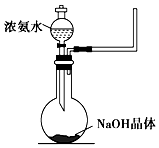 氨气是一种重要的工业产品,也是一种重要的化工原料.为研究氨气的制备及性质,某学习小组进行了下面的探究活动:
氨气是一种重要的工业产品,也是一种重要的化工原料.为研究氨气的制备及性质,某学习小组进行了下面的探究活动:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量Ba2+ 的溶液:Na+、SO42-、NH4+ | |
| B. | 0.1mol/LNa2CO3溶液:K+、AlO2-、Cl-、NO3- | |
| C. | 25°C时pH<7的溶液:K+、Cu2+、Fe3+、NO3- | |
| D. | 遇苯酚变紫色的溶液:Na+、Mg2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 将苯滴加到溴水中 | 溴水褪色 | 苯和溴发生了取代反应 |
| B | 将CO2通入CaCl2溶液中 | 溶液中有白色沉淀出现 | 生成的CaCO3难溶于水 |
| C | 用NO2气体做喷泉实验 | 液体充满烧瓶 | NO2完全溶于水 |
| D | 向氯化铵溶液中投入一铝片 | 铝片上产生大量气泡 | 氯化铵溶液显酸性,产生了 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
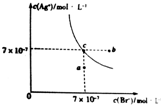 已知t℃时AgCl的Ksp=4×10-10,在此温下AgBr在水中的沉淀溶解平衡曲线如图所示.下列有关说法正确的是( )
已知t℃时AgCl的Ksp=4×10-10,在此温下AgBr在水中的沉淀溶解平衡曲线如图所示.下列有关说法正确的是( )| A. | t℃时,图中a点到c点所示溶液变化状态可加入AgBr固体 | |
| B. | 在AgBr饱和溶液中加入NaBr固体,可使溶液状态由c点到b点 | |
| C. | 在t℃时,AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)平衡常数K=28.6 | |
| D. | 在t℃时,向含Br-、Cl-的溶液中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中$\frac{c(B{r}^{-})}{c(C{l}^{-})}$为1.225×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
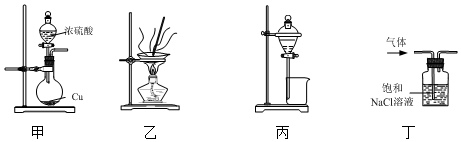
| A. | 用装置甲制取少量SO2 | |
| B. | 用装置乙蒸发FeCl3溶液制取FeCl3晶体 | |
| C. | 用装置丙分离CH3COOH和CH3COOCH2CH3的混合液 | |
| D. | 用装置丁除去Cl2中混有的少量HCl气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com