
| A. | 四种元素的原子半径大小为Z>Y>X>W | |
| B. | 元素W与氢形成的原子比为1:1的化合物只有2种 | |
| C. | X、Y、Z的最高价氧化物对应的水化物能相互反应 | |
| D. | 由Y与Z组成的化合物在熔融时能导电 |
分析 短周期元素W、X、Y、Z的原子序数依次增大,W的一种核素在考古时常用来鉴定一些文物的年代,则W为C元素;X原子核外M电子层的电子数为1,则X为Na;Y是地壳中含量最高的金属元素,则Y为Al;Z的单质可用于自来水的杀菌消毒,则Z为Cl,据此结合元素周期律与元素化合物的性质进行解答.
解答 解:短周期元素W、X、Y、Z的原子序数依次增大,W的一种核素在考古时常用来鉴定一些文物的年代,则W为C元素;X原子核外M电子层的电子数为1,则X为Na;Y是地壳中含量最高的金属元素,则Y为Al;Z的单质可用于自来水的杀菌消毒,则Z为Cl,
A.同周期元素从左到右元素的原子半径逐渐减小,一般电子层越多原子半径越大,则原子半径:X(Na)>Y(Al)>Z(Cl)>W(C),故A错误;
B.元素碳与氢形成的原子比为1:1的化合物有乙炔、苯、苯乙烯等,故B错误;
C.X、Y、Z的最高价氧化对应的水化物分别为氢氧化钠、氢氧化铝、高氯酸,氢氧化钠与高氯酸发生中和反应,氢氧化铝属于两性氢氧化物,能与氢氧化钠、高氯酸反应,故C正确;
D.由W和Z组成的物质为AlCl3,属于共价化合物,在熔融时不能导电,故D错误;
故选C.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,正确推断元素的种类为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于C2H4(g)+H2O(g)═C2H5OH(g)在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为l mol,则用分压表示的平衡常数Kp=$\frac{3}{P}$ | |
| B. | 恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)═2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol和4 mol.若此时A、B和C均增加1 mol,平衡正向移动 | |
| C. | 一恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)═2NH3(g)达到平衡状态时,N2、H2、NH3各l mol,若此时再充入3mol N2,则平衡正向移动 | |
| D. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
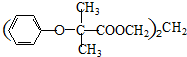
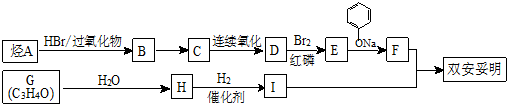
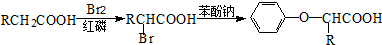
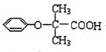 .
.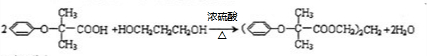 .
. .
.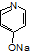 (
(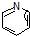 与
与 苯环性质相似)与
苯环性质相似)与 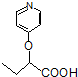 合成的路线:
合成的路线: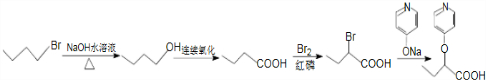 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | B极中填充多孔的炭或石墨毡,目的是为了增加导电性 | |
| B. | 电池放电时,A极电极反应为:2Na++xS+2 e-=Na2SX | |
| C. | 电池放电时,Na+向电极A极移动 | |
| D. | 电池放电的总反应为2Na+xS=Na2SX,每消耗1molNa转移2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:X<Y | |
| B. | 原子半径:Y>Z | |
| C. | 最简单氢化物的热稳定性:Z>W | |
| D. | Y元素氧化物不溶于X元素最高价氧化物对应水化物的水溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY2 | B. | X2Y3 | C. | X3Y2 | D. | XY |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2 | B. | C3H4 | C. | C4H6 | D. | C5H8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com