
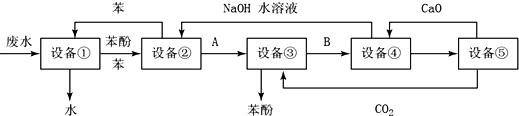
分析 由流程图和每一步新加的试剂可知:用苯萃取出设备①中的苯酚,分液后进入设备②,然后用NaOH溶液将设备②中的苯酚转化为苯酚钠而进入设备③,向设备③中通入CO2将苯酚钠转化为苯酚,同时生成NaHCO3而进入设备④,向设备④中加入CaO时,生成CaCO3进入设备⑤,NaOH进入设备②循环使用,以此来解答.
解答 解:由流程图和每一步新加的试剂可知:用苯萃取出设备①中的苯酚,分液后进入设备②,然后用NaOH溶液将设备②中的苯酚转化为苯酚钠而进入设备③,向设备③中通入CO2将苯酚钠转化为苯酚,同时生成NaHCO3而进入设备④,向设备④中加入CaO时,生成CaCO3进入设备⑤,NaOH进入设备②循环使用,
(1)由以上分析,用苯萃取出设备①中的苯酚进入设备②,所以设备①进行的是操作是分液,所有的仪器为分液漏斗、烧杯,故答案为:萃取; 分液漏斗、烧杯;
(2)由以上分析,向设备③中通入CO2将苯酚钠转化为苯酚,方程式为C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,
故答案为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3;
(3)能循环使用的物质是在流程中生成的副产物,并且在流程中需要加入的原料,根据流程图中箭头指向,很容易发现能循环使用的物质是C6H6、CaO、NaOH水溶液、CO2,故答案为:NaOH水溶液;CO2.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握有机物的结构与性质、混合物分离提纯方法、流程中的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用及实验技能的应用,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 要提纯的物质 (杂质) | 溴乙烷 (乙醇) | 乙醇 (水) | 乙醇 (乙酸) | 溴苯 (溴) |
| (1)选用试剂 | ||||
| (2)分离方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6g、0.1mol | B. | 4.6g、0.2mol | C. | 0.3g、0.2mol | D. | 5.0g、0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

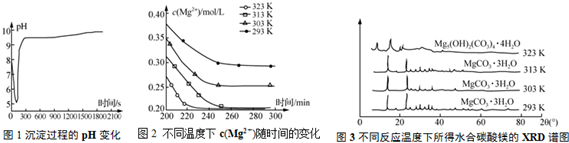
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
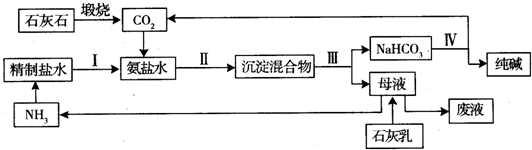
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
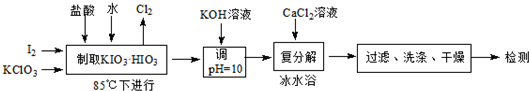
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
| KCl | 28.1 | 31.2 | 34.2 | 40.1 | 45.8 | 51.3 |
| Ca(IO3)2 | 0.119 | 0.195 | 0.3071 | 0.520 | 0.621 | 0.669 |
| 碘酸钙存在形态 | 无水盐 | 一水合物 | 六水合物 |
| 稳定时的温度区域 | >57.5℃ | 32-57.5℃ | <32℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
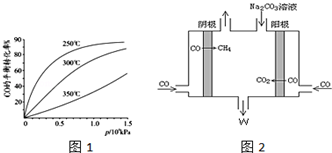
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
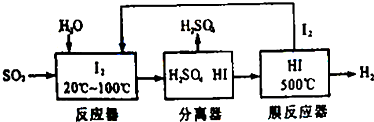
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②③④⑥ | C. | ①②④⑤ | D. | ①②③⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com