
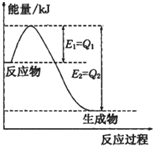
 反应A(g)+B(g)═C(g)+D(g)过程中的能量变化如右图所示,则该反应是
反应A(g)+B(g)═C(g)+D(g)过程中的能量变化如右图所示,则该反应是科目:高中化学 来源: 题型:
 已知0.1mol?L-1的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+.欲使平衡发生如图变化,可以采取的措施是( )
已知0.1mol?L-1的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+.欲使平衡发生如图变化,可以采取的措施是( )| A、加少量烧碱溶液 | B、升高温度 |
| C、加少量冰醋酸 | D、加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
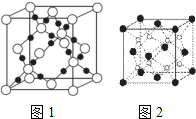 四种短周期元素A、B、C、D的原子序数依次递增.其中A、B、C三种种元素基态原子的2p能级上都有未成对电子.且未成对电子个数分别是2、3、2;D与C可以形成D2C和D2C2两种化合物.回答下列问题:
四种短周期元素A、B、C、D的原子序数依次递增.其中A、B、C三种种元素基态原子的2p能级上都有未成对电子.且未成对电子个数分别是2、3、2;D与C可以形成D2C和D2C2两种化合物.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 我国工业上主要采用以下四种方法降低尾气中的含硫量:
我国工业上主要采用以下四种方法降低尾气中的含硫量:| 方法1 | 燃煤中加入石灰石,将SO2转化为CaSO3,再氧化为CaSO4 |
| 方法2 | 用氨水将SO2转化为NH4HSO3,再氧化为(NH4)2SO4 |
| 方法3 | 高温下用水煤气将SO2还原为S |
| 方法4 | 用Na2SO3溶液吸收SO2,再电解转化为H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2c(H2CO3)+c(HCO3-)+c(H+)═c(OH-) |
| B、c(Na+)═c(HCO3-)+c(H2CO3)+2c(CO32-) |
| C、c(Na+)>c(H+)>c(OH-)>c(CO32-) |
| D、c(Na+)+c(H+)═c(HCO3-)+c(OH-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
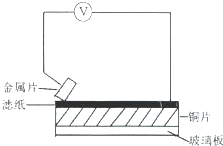 将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )
将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )| 金属片 | 电子流向 | 电压(V) |
| X | X→Cu | +0.78 |
| Y | Cu→Y | -0.15 |
| Z | Z→Cu | +1.35 |
| A、Z金属可作为牺牲阳极保护法的阳极,保护Y金属 |
| B、Y金属不能从硫酸溶液中置换出氢气 |
| C、三种金属的活泼性顺序为:Z>X>Y |
| D、X和Y能构成电压最大的原电池 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com