
【题目】有机物A仅含有C、H、O三种元素,可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
限选试剂:蒸馏水、2 mol·L-1盐酸溶液、2 mol·L-1NaOH溶液、浓硫酸、NaHCO3粉末、金属Na、无水乙醇
实验步骤 | 实验结论 |
(1)A的质谱图如下: | (1)证明A的相对分子质量为:__________。 |
(2)将此9.0 g A在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4 g和13.2 g。 | (2)证明A的分子式为: ________________。 |
(3)另取两份9.0 g A分置于不同的试管中。往其中一份A中加入足量的NaHCO3粉末充分反应,生成_______ L CO2(标准状况)。 往另一份A中加入足量的金属钠充分反应,生成________________________ L H2(标准状况)。 | (3)证明A的分子中含有一个羧基和一个羟基。 |
(4)A的核磁共振氢谱如下图: | (4)A的结构简式为: __________________。 |
【答案】90 C3H6O3 2.24 2.24 ![]()
【解析】
(1)根据质谱图可知,该有机物的相对分子质量为90。
(2)产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4 g和13.2 g,这说明生成的水是5.4g、CO2是13.2g。其中水的物质的量是5.4g÷18g/mol=0.3mol,含有氢原子的物质的量是0.6mol;CO2的物质的量是13.2g÷44g/mol=0.3mol,碳原子的物质的量是0.3mol。9.0gA的物质的量是9.0g÷90g/mol=0.1mol,所以根据原子守恒可知,A分子中含有3个碳原子和6个氢原子。则含有的氧原子个数是![]() 个,所以该有机物的化学式是C3H6O3。
个,所以该有机物的化学式是C3H6O3。
(3)A分子中含有1个羧基,所以0.1molA跟足量的NaHCO3粉末反应,生成0.1mol CO2,在标准状况下的体积是0.1mol×22.4L/mol=2.24L;A中还含有1个羟基,则0.1molA和足量的金属钠反应可以生成0.1mol氢气,在标准状况下的体积是0.1mol×22.4L/mol=2.24L。
(4)根据A的核磁共振氢谱可知,分子中含有4类氢原子,所以A的结构简式是![]() 。
。


科目:高中化学 来源: 题型:
【题目】如表所示有关物质检验的实验结论正确的是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有 |
B | 向某溶液中加入盐酸,将生成的气体通入品红溶液中,品红溶液褪色 | 该溶液一定含有 |
C | 将SO2通入Na2CO3溶液中生成的气体,先通入足量的酸性KMnO4溶液,再通入澄清石灰水中有浑浊 | 说明酸性:H2SO3>H2CO3 |
D | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量硫酸亚铁和硫酸铁混合物样品溶于水,配成100mL溶液。所得溶液分成二份,在第一份溶液中加入0.5mol·L-1氯化钡220mL恰好完全反应;在第二份溶液中通入标准状况下的氯气0.896L,可使Fe2+全部变成Fe3+。
(1)所取样品中硫酸亚铁物质的量是___。
(2)在第一份溶液完全反应后的溶液中再加入足量氢氧化钠溶液,所得沉淀经洗涤后,在空气中充分灼烧,得到残渣的质量是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的化合价与其形成物质类别的关系如图所示。下列说法错误的是( )
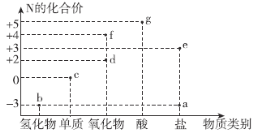
A.b与O2在一定条件下反应可以生成d
B.c既有氧化性,又有还原性
C.f的化学式一定为NO2
D.g与b可化合生成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,共产生NO气体4.48L(标准状况),向所得溶液中加入物质的量浓度为3mol/L的NaOH溶液至沉淀完全。则下列有关叙述中不正确的是
A.开始加入合金的物质的量之和为0.3mol
B.生成沉淀的质量比原合金的质量增加10.2g
C.沉淀完全时消耗NaOH溶液的体积为200mL
D.反应中被还原和未被还原的硝酸物质的量之比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钠在有机合成中用途广泛。某学习小组利用如图所示装置制备NaH。下列说法正确的是( )
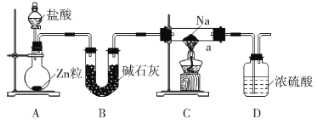
A.装置B可用装置D代替
B.装置D用于处理尾气
C.实验后,将a中固体加入水中,若有H2生成,则证明固体为NaH
D.装置A也可用于KMnO4与浓盐酸反应制备Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)![]() 2C(g)+D(g)经2min后,B的浓度减少了0.6mol·L-1。下列说法正确的是( )
2C(g)+D(g)经2min后,B的浓度减少了0.6mol·L-1。下列说法正确的是( )
A.用A表示的化学反应速率是0.4mol·L-1·min-1
B.分别用B、C、D表示化学反应速率,其比是3∶2∶1
C.在2min末的反应速率用B表示是0.3mol·L-1·min-1
D.在这2min内B和C两物质的浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、Al2O3等杂质。工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
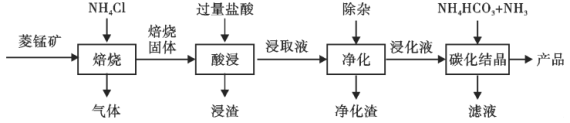
已知:MnCO3+2NH4Cl=MnCl2+CO2↑+2NH3↑+H2O.
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 |
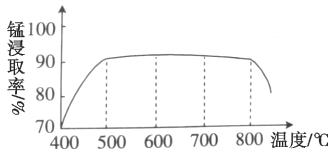
(1)焙烧时温度对锰浸取率的影响如图。焙烧时适宜的温度为___________左右;800℃以上锰的浸取率偏低,可能的原因是___________。
(2)净化包含三步:①加入少量MnO2,添加少量MnO2的作用是____________。发生反应的离子方程式为___________。
②加氨水调pH,溶液的pH范围应调节为___________~8.1之间。生成的沉淀主要是___________。
③加入MnF2,沉淀除去Ca2+,若溶液酸度过高,Ca2+沉淀不完全,原因是___________。
(3)碳化结晶中生成MnCO3的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下的反应:3H2 (g)+N2 (g) ![]() NH3 (g),达到限度的标志是( )
NH3 (g),达到限度的标志是( )
A.H2、N2、NH3的分子个数之比为3:1:2B.N2的正反应速率和逆反应速率相等
C.反应已经停止D.单位时间内生成3mol H2,同时生成1mol N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com