
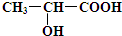
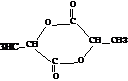 、
、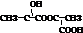 ;
; 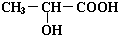 +2Na→
+2Na→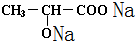 +H2↑;
+H2↑;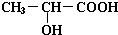 +Na2CO3=2
+Na2CO3=2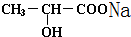 +CO2↑+H2O.
+CO2↑+H2O. 分析 (1)当乳酸在浓硫酸催化加热条件下发生酯化反应时,能产生多种酯类化合物,其结构简式分别为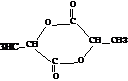 、
、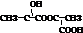 ;
;
(2)乳酸发生催化氧化时,醇羟基被氧化生成羰基;
(3)醇羟基和羧基都和钠反应生成氢气;
(4)只有羧基能和碳酸钠反应生成羧酸钠和二氧化碳、水.
解答 解:(1)当乳酸在浓硫酸催化加热条件下发生酯化反应时,能产生多种酯类化合物,其结构简式分别为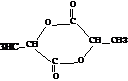 、
、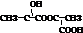 ,
,
故答案为: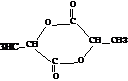 ;
;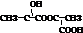 ;
;
(2)乳酸发生催化氧化时,醇羟基被氧化生成羰基,其结构简式为,故答案为:CH3COCOOH
(3)醇羟基和羧基都和钠反应生成氢气,反应方程式为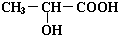 +2Na→
+2Na→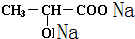 +H2↑,
+H2↑,
故答案为: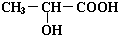 +2Na→
+2Na→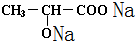 +H2↑;
+H2↑;
(4)只有羧基能和碳酸钠反应生成羧酸钠和二氧化碳、水,反应方程式为2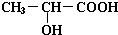 +Na2CO3=2
+Na2CO3=2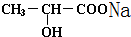 +CO2↑+H2O,
+CO2↑+H2O,
故答案为:2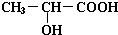 +Na2CO3=2
+Na2CO3=2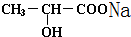 +CO2↑+H2O.
+CO2↑+H2O.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系是解本题关键,注意乳酸能发生分子内酯化反应、分子间酯化反应,还能发生缩聚反应.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯和水 酒精和水 | B. | 汽油和水 苯和水 | ||
| C. | 菜籽油和水 甲酸和水 | D. | 苯和水 乙酸和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 装置 | 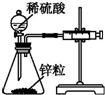 | 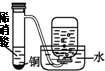 | 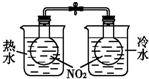 | 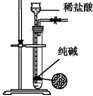 |
| 实验 | 结合秒表粗略测量锌与硫酸的反应速率 | 制备并收集少量NO气体 | 验证温度对化学平衡的影响 | 实验室随时制取少量CO2气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去 | |
| B. | 乙醇能溶解很多有机物和无机物,可用乙醇提取中药中的有效成分 | |
| C. | 乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒 | |
| D. | 乙醇容易挥发,所以才有“酒香不怕巷子深”的俗语 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,11.2L的CHCl3所含的分子数为0.5NA | |
| B. | 17g羟基(-OH)所含有的电子数是10NA | |
| C. | 9.2g甲苯和丙三醇的混合物中,含氢原子数目为0.8NA | |
| D. | 现有乙烯、丙烯的混合气体共28g,其中碳原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
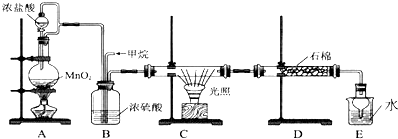
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com