
医用氯化钙可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、A13+、Fe3+等杂质)生产医用二水合氯化钙晶体(CaCl2·2H2O的质量分数为97.3—103.0%),工艺流程为:
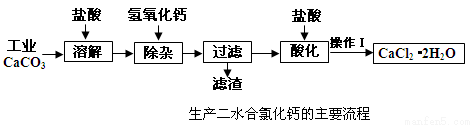
(1)CaCO3与盐酸反应的离子方程式 。
(2)①加入氢氧化钙溶液调节溶液的PH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为 。
②过滤时需用的玻璃仪器除烧杯、玻璃棒外还有 。
(3)酸化时加盐酸将溶液的PH调节到4.0左右,其目的为:① ,
②防止Ca2+在蒸发时发生水解。
(4)操作Ⅰ中应包括 、 、过滤等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取0.735g样品配成250mL溶液,量取该溶液25.00mL于锥形瓶中,用0.05mol/L AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL。
①通过计算,样品含CaCl2·2H2O的质量百分数为 (只写计算式不计算结果)。
②若所测样品CaCl2·2H2O的质量百分数偏高(忽略其它实验操作误差),可能的原因之一为 。
(1)CaCO3+2H+=Ca2++CO2↑+H2O(2分)
(2)①Al(OH)3、Fe(OH)3(2分),②普通漏斗(1分)
(3)除去过量的氢氧化钙(2分,合理则给分);
(4)(蒸发1分、结晶1分),(或写蒸发浓缩、降温结晶)
(5)①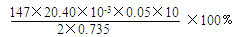 (3分)
(3分)
②Na+没除去,可能析出NaCl,导致测定结果偏大(3分,合理则给分)
【解析】
试题分析:(1)碳酸钙与盐酸反应生成氯化钙、水、二氧化碳,离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O;
(2)①加入氢氧化钙溶液调节溶液的PH为8.0—8.5,此时A13+、Fe3+沉淀完全,所以滤渣主要成分是Al(OH)3、Fe(OH)3;
②过滤时需用的玻璃仪器有烧杯、玻璃棒、普通漏斗,所以还需要普通漏斗;
(3)因为除杂操作中氢氧化钙是过量的,所以加入盐酸将溶液的PH调节到4.0左右,其目的之一是除去过量的氢氧化钙;
(4)从溶液得到晶体,需要蒸发浓缩、降温结晶,得到氯化钙晶体;
(5)①用0.05mol/L AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL,则溶液中氯离子的物质的量是20.40×10-3L×0.05 mol/L,所以250mL溶液中CaCl2·2H2O的质量是20.40×10-3L×0.05 mol/L×10/2×147g/mol,则CaCl2·2H2O的质量分数为20.40×10-3L×0.05 mol/L×10/2×147g/mol/0.735g;
②若所测样品CaCl2·2H2O的质量百分数偏高,可能的原因是氯化钠未除去,析出氯化钠固体,导致消耗硝酸银溶液偏多,测定结果偏大。
考点:考查对工艺流程的分析,质量分数的计算,实验仪器的判断,误差分析


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源:2015届辽宁省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.澄清石灰水与过量小苏打溶液混合:Ca2+ + OH- + HCO3-== CaCO3↓+H2O
B.碳酸钙溶于醋酸: CaCO3 + 2H+ =Ca2+ + CO2↑+ H2O
C.盛装氢氧化钠溶液的试剂瓶不可以用玻璃塞:SiO2+ 2Na+ +2 OH--= Na2SiO3+H2O
D.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全:Ba2+ + 2OH- + NH4+ + H+ + SO42- = BaSO4↓+ NH3·H2O + H2O
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省高三上学期10月月考试卷(解析版) 题型:选择题
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
物质 编号 | 物质转化关系 | 甲 | 乙 | 丙 | 丁 |
① |
| Cu | CuO | CuSO4 | Cu(NO3)2 |
② | Na2CO3 | NaOH | NaHCO3 | CO2 | |
③ | (NH4)2SO3 | CaSO3 | SO2 | NH4HSO3 | |
④ | Fe | FeCl3 | FeCl2 | Fe(NO)2 |
A.①②③④ B.①②③ C.①③④ D.②④
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省分校高三上学期期初考试化学试卷(解析版) 题型:选择题
历史上最早应用的还原性染料是靛蓝,其结构简式如图所示,下列关于靛蓝的叙述中错误的是
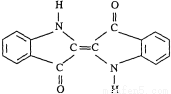
A.靛蓝由碳、氢、氧、氮四种元素组成
B.它的分子式是C16H10N2O2
C.该物质是高分子化合物
D.它是不饱和的有机物
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省分校高三上学期期初考试化学试卷(解析版) 题型:选择题
室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是( )
A.NH+4、Cu2+、Cl-、NO-3 B.K+、Na+、SO2-3、S2-
C.K+、Na+、AlO-2、SO2-4 D.Ba2+、Fe2+、NO-3、Br-
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省大连市高三10月月考理综化学试卷(解析版) 题型:选择题
中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去)。下列推断不正确的是
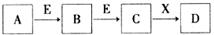
A.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
B.若D是一种强碱,则A、B、C均可与X反应生成D
C.若D为NaCl,且A可与C反应生成B,则E可能是CO2
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
查看答案和解析>>
科目:高中化学 来源:2015届辽宁沈阳市高三上学期第一次模拟考试化学试卷(解析版) 题型:实验题
某化学课外兴趣小组用下图所示装置探究铜跟浓硫酸的反应情况:
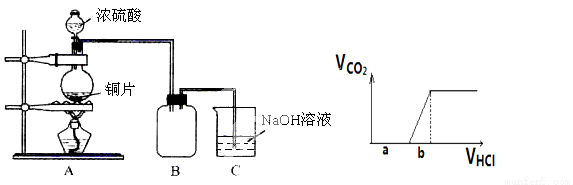
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整。
(2)实验中他们取6.4g 铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①写出铜跟浓硫酸反应的化学方程式:__________;
②有一定量的余酸但未能使铜片完全溶解,你认为其中原因是__________;
(3)为定量测定余酸的物质的量浓度,该小组学生进行了如下设计:
先测定铜与浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度。他们认为测定二氧化硫的量的方法有多种,你认为下列实验方案中可行的是_______(填写编号,仅有一个正确)。
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
请你对不可行的方案中选出一例进行分析:__________ [要求标明不可行的方案序号、说出不可行的理由及造成的误差(偏高或偏低)]。
请你再设计一种其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测 定的数据(不必计算)__________。
查看答案和解析>>
科目:高中化学 来源:2015届辽宁沈阳市高三上学期第一次模拟考试化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式正确的是
A.Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O
B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH) 3↓+HCO3-
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期第二次月考化学试卷(解析版) 题型:选择题
在0.1 mol·Lˉ1醋酸溶液中加入少量0.1 mol·Lˉ1盐酸,下列叙述正确的是 ( )
A.CH3COOH的电离度减小,pH减小
B.平衡向生成CH3COOH方向移动,c(H+)减小
C.CH3COOH的电离度增大,c(H+)增大
D.电离平衡向生成CH3COOˉ、H+方向移动,pH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com