
【题目】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势如图所示:
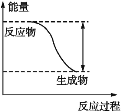
(1)该反应为_________(填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率增大,下列措施可行的是_________(填字母)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度 D.使用催化剂
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为:_________(填“正”或“负”)极,该极上发生的电极反应为:_________,外电路中电子移动方向为:_________。
【答案】放热 ACD 正 2H++2e-═H2↑ 由负极Fe流向正极Cu
【解析】
(1)由图:反应物总能量大于生成物总能量,则该反应为放热反应;
(2)A.将铁片改为铁粉,增大反应物接触面积,化学反应速率加快,故A符合题意;
B.将稀硫酸改为浓硫酸,浓硫酸和铁发生钝化现象而阻止进一步反应,所以化学反应速率减慢,故B不符合题意;
C.升高温度,化学反应速率加快,故C符合题意;
D.使用催化剂,化学反应速率加快,故D符合题意;
故选ACD;
(3)Cu、Fe和稀硫酸构成原电池,易失电子的金属Fe作负极,负极上电极反应式为Fe-2e-=Fe2+;另一种金属Cu作正极;Cu电极上氢离子得电子生成氢气,所以看到的现象是有无色气体生成,电极反应式为2H++2e-═H2↑,电子由负极Fe流向正极Cu。


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
【题目】化合物M具有广谱抗菌活性,合成M的反应可表示如下:
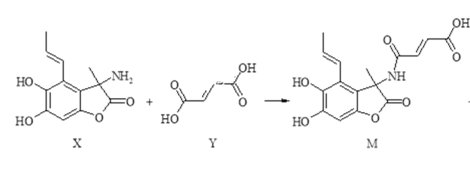 +H2O
+H2O
下列说法正确的是( )
A.X分子中有5种官能团
B.Y分子中所有原子不可能在同一平面内
C.可用FeCl3溶液或NaHCO3溶液鉴别X和M
D.在NaOH溶液中,1molX最多可与4molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,容积2L的密闭容器中,将2molL气体和3molM气体混合,发生如下反应:2L(g)+3M(g)![]() xQ(g)+3R(g),10s末,生成2.4molR,测得Q的浓度为0.4mol·L-1。计算:
xQ(g)+3R(g),10s末,生成2.4molR,测得Q的浓度为0.4mol·L-1。计算:
(1)10s末L的物质的量浓度为_________。
(2)前10s内用M表示的化学反应速率为_________。
(3)化学方程式中x值为_________。
(4)L的转化率是_________。
(5)下列还可以说明该反应已达平衡的是_________(填序号)。
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④v正(M)=2v逆(R)
⑤n(L)∶n(M)∶n(R)=2∶3∶3
(6)在其它条件不变时,减小压强,化学反应反应速率_________(增大、减小、不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学需用480 mL 0.5 mol·L-1Na2CO3溶液,在实验室进行配制。
(1)该同学用托盘天平应称量________g Na2CO3粉末,使用容量瓶前必须进行的一步操作是______。
(2)下图是该同学配制的一些关键步骤和操作图。

配制过程的先后顺序为(用字母A~F填写)________________。
(3)步骤A通常称为洗涤,如果没有步骤A,则配得溶液的浓度将________(填“偏高”、“偏低”、“不变”);步骤F如果俯视刻度线,配得溶液的浓度将_______(填“偏高”、“偏低”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S4N4的结构如图:
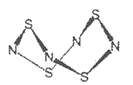
(1)S4N4的晶体类型是__。
(2)用干燥的氨作用于S2Cl2的CCl4,溶液中可制S4N4。化学反应方程为:6S2Cl2+16NH3=S4N4+S8+12NH4Cl
①上述反应过程中,没有破坏或形成的微粒间作用力是__。
a.离子键 b.极性键 c.非极性键 d.金属键 e.配位键 f.范德华力
②S2Cl2中,S原子轨道的杂化类型是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.4 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。
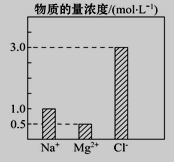
(1)该混合液中,NaCl的物质的量为________mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为_________mol,将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为___________mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。试回答:

(1)若X是强氧化性单质,则A不可能是____。
a.S b.N2 c.Na d.Mg e.Al
(2)若A为强碱溶液,则X可能为____。
a.CO2 b.AlCl3 c.Al d.Mg e.Al2O3
(3)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为____;C溶液在贮存时应加入少量X,理由是(离子方程式表示)___,检验此C溶液中金属元素价态的操作方法是____。
(4)若A、B、C为含有金属元素的化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为____,X的化学式可能为(写出不同类物质)____或____,反应②的离子方程式为___或___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X(g)+Y(g)=Z(g)+W(g)的能量变化如图所示,下列有关该反应的说法中错误的是

A.断开1molX(g)和1molY(g)中的化学键,要吸收akJ能量
B.1molZ(g)和1molW(g)所具有的能量为bkJ
C.每生成1molZ(g)和1molW(g)吸收ckJ能量
D.升高温度,可加快该反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室回收废水中苯酚的过程如图所示。下列分析错误的是
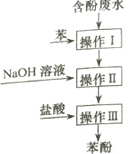
A. 操作I中苯作萃取剂
B. 苯酚钠在苯中的溶解度比在水中的大
C. 通过操作II苯可循环使用
D. 三步操作均需要分液漏斗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com