
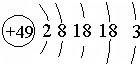 张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )| A. | In为长周期元素 | B. | In的最高正化合价为+3 | ||
| C. | In容易导电导热 | D. | In和铝同主族,金属性比铝弱 |
分析 由In原子结构示意图可知,原子核外有5个电子层,最外层电子数为3,处于第五周期ⅢA族,同主族自上而下金属性增强,故In金属性比Al强,属于金属元素.
解答 解:由In原子结构示意图可知,原子核外有5个电子层,最外层电子数为3,处于第五周期ⅢA族.
A.In原子核外有5个电子层,处于第五周期,属于长周期元素,故A正确;
B.In原子最外层电子数为3,In的最高正化合价为+3,故B正确;
C.同主族自上而下金属性增强,故In金属性比Al强,属于金属元素,In容易导电导热,故C正确;
D.In处于第五周期ⅢA族,和铝同主族,同主族自上而下金属性增强,故In金属性比Al强,故D错误,
故选D.
点评 本题考查结构性质位置关系应用,注意理解掌握同主族元素性质相似性与递变性,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
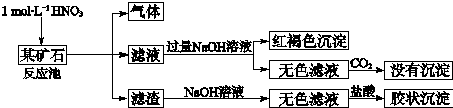
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液.
如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 117.9 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH=CH2 1,3二丁烯 | B. | 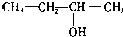 3-丁醇 | ||
| C. | 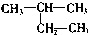 2-甲基丁烷 2-甲基丁烷 | D. | 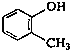 甲基苯酚 甲基苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L氧气含有的原子数目为NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| C. | 在标准状况下,22.4 L水的质量约为18g | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol | B. | 0.4mol | C. | 0.6mol | D. | 0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com