
 .
.分析 A、B、C、D为同一周期的4种元素,C、D离子的电子层结构与氩原子相同,C点燃时与氧气反应生成的氧化物可与C的气态氢化物反应得到C的单质,则C为S元素;D单质常温下为气态,则D为Cl元素;0.2molA的单质与足量盐酸反应,能置换出2.24LH2(标况下),则A为金属,令A的化合价为x,根据电子转移守恒有:0.2x=$\frac{2.24}{22.4}$×2,x=1,故A为Na元素;B的氧化物既可溶于酸又可溶于强碱溶液,则B为Al,据此解答.
解答 解:A、B、C、D为同一周期的4种元素,C、D离子的电子层结构与氩原子相同,C点燃时与氧气反应生成的氧化物可与C的气态氢化物反应得到C的单质,则C为S元素;D单质常温下为气态,则D为Cl元素;0.2molA的单质与足量盐酸反应,能置换出2.24LH2(标况下),则A为金属,令A的化合价为x,根据电子转移守恒有:0.2x=$\frac{2.24}{22.4}$×2,x=1,故A为Na元素;B的氧化物既可溶于酸又可溶于强碱溶液,则B为Al.
(1)由上述分析可知,A为钠元素,B为铝元素,C为硫元素,D为氯元素,故答案为:钠;铝;硫;氯;
(2)B为Al元素,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)C为硫元素,处于周期表中第三周期VIA族,故答案为:三;VIA.
点评 本题考查位置结构性质关系应用,熟练掌握元素化合物知识,侧重对基础知识的巩固.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 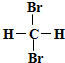 和 和 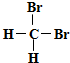 是同一物质 是同一物质 | |
| B. | 1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但它不能解释的事实是邻二溴苯只有一种. | |
| C. | 某有机物化学式为C3H6O2,其核磁共振氢谱有三个峰,其强度比为3:2:1,则该有机物的结构简式一定是CH3CH2COOH | |
| D. | 在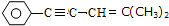 分子中一定共面的碳原子最多为9个,可能共面的碳原子最多为12个 分子中一定共面的碳原子最多为9个,可能共面的碳原子最多为12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ;其中有一种分子中,所有碳原子都在同一平面内,它发生加聚反应的化学方程式为:
;其中有一种分子中,所有碳原子都在同一平面内,它发生加聚反应的化学方程式为: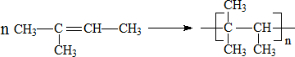 .
.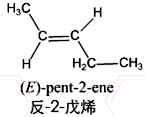 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
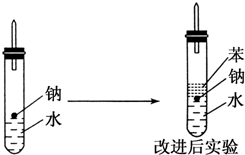 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液.为分析上述三个反应生成的H2,他们设计了如下装置图.
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液.为分析上述三个反应生成的H2,他们设计了如下装置图.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 应密封保存 | |
| B. | 完全燃烧的反应属于复分解反应 | |
| C. | 可用作燃料 | |
| D. | 其中氮元素与氢元素的质量比为14:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
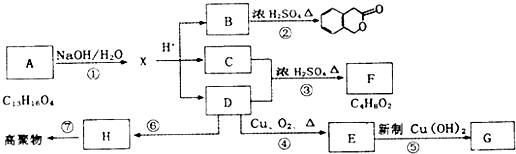
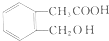
 ④
④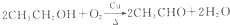 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2可用于杀菌、消毒,但不可用来加工食品 | |
| B. | 液氨汽化时要吸收大量热,因此氨常用作制冷剂 | |
| C. | PM2.5是指大气中直径小于或等于2.5微米的细小可吸入颗粒物,其分散在空气中能形成气溶胶 | |
| D. | 铝箔在酒精灯上加热铝熔化但不滴落,说明氧化铝的熔点高于铝的熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| J | ||||
| R |
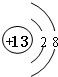 ;元素T周期表中位于第ⅦA族.
;元素T周期表中位于第ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
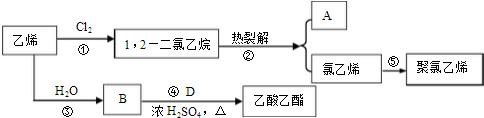
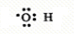 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com