
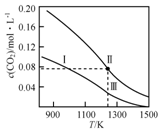
 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 反应CO2(g)+C(s)?2CO(g)△S>0、△H<0 | |
| B. | 体系的总压强P总:P总(状态Ⅱ)=2P总(状态Ⅰ) | |
| C. | 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
分析 A.由气体的化学计量数增大可知△S,由图中温度高平衡时c(CO2)小可知△H;
B.分别加入0.1molCO2和0.2molCO2,曲线I为加入0.1molCO2,曲线II为加入0.2molCO2,加压CO2(g)+C(s)?2CO(g)平衡逆向移动;
C.状态II、状态Ⅲ的温度相同,状态II看作先加入0.1molCO2,与状态Ⅲ平衡时CO的浓度相同,再加入0.1molCO2,若平衡不移动,Ⅱ状态CO的浓度等于2倍Ⅲ,但再充入CO2,相当增大压强,平衡左移动,消耗CO;
D.状态I、状态Ⅲ的温度不同,温度高反应速率快.
解答 解:A.由气体的化学计量数增大可知△S>0,由图中温度高平衡时c(CO2)小,则升高温度平衡正向移动,可知△H>0,故A错误;
B.分别加入0.1molCO2和0.2molCO2,曲线I为加入0.1molCO2,曲线II为加入0.2molCO2,若平衡不移动,体系的总压强为P总(状态Ⅱ)=2P总(状态Ⅰ),但加压CO2(g)+C(s)?2CO(g)平衡逆向移动,为使c(CO2)相同,则加热使平衡正向移动,则体系的总压强为P总(状态Ⅱ)>2P总(状态Ⅰ),故B错误;
C.状态II、状态Ⅲ的温度相同,状态II看作先加入0.1molCO2,与状态Ⅲ平衡时CO的浓度相同,再加入0.1molCO2,若平衡不移动,Ⅱ状态CO的浓度等于2倍Ⅲ,但再充入CO2,相当增大压强,平衡左移,消耗CO,则c(CO,状态Ⅱ)<2c(CO,状态Ⅲ),故C正确;
D.状态I、状态Ⅲ的温度不同,温度高反应速率快,则逆反应速率为V逆(状态Ⅰ)<V逆(状态Ⅲ),故D错误;
故选C.
点评 本题考查化学平衡及平衡的建立,为高频考点,题目难度中等,明确平衡移动的影响因素、图象分析为解答的关键,选项BC为解答的难点,试题培养了学生的分析能力及灵活应用能力.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温时,溶液中c(CH3COO-):①<② | |
| B. | 加水稀释①,溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$变大 | |
| C. | 向②中滴加①至溶液呈中性,滴加过程中水的电离平衡正向移动 | |
| D. | 向②中滴加①至溶液呈中性,溶液中c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 21:5 | B. | 2:1 | C. | 3:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+稀HNO3 | B. | Cu$\stackrel{空气、△}{→}$CuO$\stackrel{硝酸}{→}$Cu(NO3)2 | ||
| C. | Cu+浓HNO3 | D. | Cu$\stackrel{Cl_{2}}{→}$CuCl2 $\stackrel{AgNO_{3}}{→}$ Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
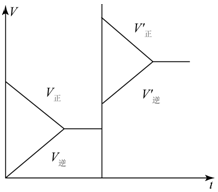 对于达平衡的可逆反应X+Y?W+Z,增大压强则正、逆反应速度(v)的变化如图,分析可知X、Y、Z,W的聚集状态可能是( )
对于达平衡的可逆反应X+Y?W+Z,增大压强则正、逆反应速度(v)的变化如图,分析可知X、Y、Z,W的聚集状态可能是( )| A. | Z、W为气体,X、Y中之一为气体 | B. | X、Y中之一为气体,Z、W为非气体 | ||
| C. | X、Y、Z、W皆为气体 | D. | X、Y为气体,Z、W中之一为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg•L-1 | 0 | 20 | 40 | 60 | 80 |
| 实验方案 | 实验现象 | 实验结论 |
| 取5ml待测液加入维生素C,振荡,再加入1mlM溶液,加入至蒸馏水10mL,再振荡,与③好色阶对比 | 紫红色比③色阶浅 | 维生素C可以有效降低NaNO2的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{84{w}_{2}-53{w}_{1}}{31{w}_{1}}$ | B. | $\frac{84{w}_{2}-53{w}_{1}}{31{w}_{1}}$ | ||
| C. | $\frac{84{w}_{2}-53{w}_{1}}{31{w}_{1}}$ | D. | $\frac{115{w}_{2}-84{w}_{1}}{31{w}_{1}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com