
(共10分)以下框图中A~M是中学化学常见的物质,其中A、E是金属,F和J为气体单质,其余均为化合物或其溶液,C为淡黄色固体,D为红棕色粉末,M为红褐色固体。
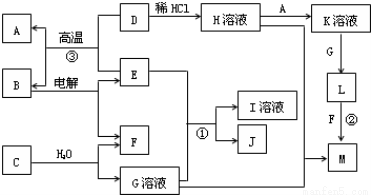
(1)B的化学式______;
(2)19.5gC与足量的水反应转移电子的物质的量为______mol;
(3)写出物质C的电子式 ;
(4)写出②、③反应的离子方程式② ,③ 。
(各2分,共10分)
(1)Al2O3;
(2)0.25mol;
(3) 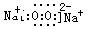
(4)②4Fe(OH)2+O2+2H2O = 4Fe(OH)3,
③2Al+Fe2O3  Al2O3 + 2Fe。(条件不扣分,离子写错0分)
Al2O3 + 2Fe。(条件不扣分,离子写错0分)
【解析】
试题分析:由题意可知,C是Na2O2,则F 是氧气,G是NaOH;D为红棕色粉末,M为红褐色固体,则D
是Fe2O3,M是Fe(OH)3,Fe2O3与Al在高温下发生铝热反应生成Fe和Al2O3,所以A 是Fe,B是Al2O3,E是Al,Al与NaOH溶液反应生成偏铝酸钠和氢气,所以J是氢气,I是偏铝酸钠;D是Fe2O3,H是氯化铁,与铁反应生成氯化亚铁,所以F是Fe(OH)2。
B的化学式为Al2O3,
19.5g Na2O2的物质的量是0.25mol,与水的反应中有一半作了氧化剂,一半作了还原剂,所以0.25mol过氧化钠与水反应转移电子的物质的量是0.25mol×1/2×2=0.25mol;
过氧化钠是离子化合物,其电子式为 ;
;
反应②是氢氧化亚铁与氧气转化为氢氧化铁的反应,化学方程式为4Fe(OH)2+O2+2H2O = 4Fe(OH)3,反应③是铝热反应,化学方程式为2Al+Fe2O3  Al2O3 + 2Fe。
Al2O3 + 2Fe。
考点:考查物质的推断,氧化还原反应的计算,化学式、化学方程式、电子式的书写


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014四川省宜昌市春季期中考试高二化学试卷(解析版) 题型:填空题
A、B、C、D代表元素周期表中4种元素,请完成下列问题
(1)A元素的基态原子的最外层有3个未成对电子,次外层有2个电子,该元素氢化物比同族元素氢化物熔沸点高的原因是 ;第一电离能比后面一号元素大的原因是
(2)B元素与氧元素形成的一种化合物是含有4个原子18个电子的分子,该化合物的电子式为 ,若向该化合物的稀溶液中加入少量二氧化锰,有无色气体产生,该反应的化学方程式为
(3)C元素的正三价离子的 3d轨道为半充满状态,C元素的符号为 ,在同期表中位于 周期 族,原子结构示意图为
(4)D元素位于元素周期表第四周期第ⅠB族,其基态原子的电子排布式为
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省长春市高二下学期期末考试化学试卷(解析版) 题型:填空题
(10分)2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为:
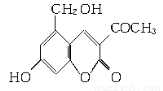
它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
(1)“亮菌甲素”的分子式为________。
(2)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。 写出其属于醇类的同分异构体的结构简式___________________________________________________。
(3)下列有关“亮菌甲素”的叙述正确的是________(填字母)。
A.“亮菌甲素”能与H2发生加成反应
B.不能使酸性KMnO4溶液褪色
C.“亮菌甲素”分子中含氧官能团只有2种
D.1 mol“亮菌甲素”最多与3 mol NaOH反应
(4)核磁共振氢谱分析,发现二甘醇分子中有3个吸收峰,其峰面积之比为2∶2∶1。又知二甘醇中C、O元素的质量分数相同,且H的质量分数为9.4%,1 mol二甘醇与足量金属钠反应生成1 mol H2。写出二甘醇与乙酸(按物质的量之比1∶1)反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省长春市高二下学期期末考试化学试卷(解析版) 题型:选择题
分类是化学研究的重要方法之一,下列有关说法中,正确的是
A.SO2、NO2、和CO2都属于酸性氧化物
B.甲烷和和一氯甲烷都属于烷烃
C.HC1O是弱电解质,NaClO却属于强电解质
D.在水溶液中能电离出H+的化合物都属于酸
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省长春市高二下学期期末考试化学试卷(解析版) 题型:选择题
原计划实现全球卫星通讯需发射77颗卫星,这一数字与铱(Ir)元素的原子核外电子数恰好相等,因此称为“铱星计划”.已知铱的一种同位素的质量数为191,则其核内的中子数与质子数之差是
A.77 B.114 C.37 D.268
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省长春市高一下学期期末考试化学试卷(解析版) 题型:选择题
相同条件下,0.1mol/L Na2S2O3溶液和0.1mol/L H2SO4溶液各5mL,与10mL水混合,反应时间为t1 s;0.2mol/L Na2S2O3溶液和0.2mol/L H2SO4溶液各5mL,与30mL水混合,反应时间为t2 s,则t1和t2的关系是(忽略体积变化)
A. t1>t2 B. t1<t2 C. t1=t2 D.不能肯定
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省长春市高一下学期期末考试化学试卷(解析版) 题型:选择题
关于下图所示装置(盐桥含KCl)的叙述,正确的是
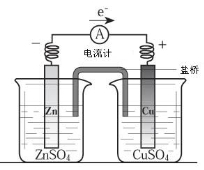
A.铜离子在铜片表面被氧化
B.铜作阳极,铜片上有气泡产生
C.电流从锌片经导线流向铜片
D.右侧烧杯中,SO42-的物质的量几乎不变,K+的数目增多
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高二上学期期末考试化学(B卷)试卷(解析版) 题型:选择题
体积相同的甲、乙两个容器中,分别充入等物质的量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g) 2SO3(g),并达到平衡,在此过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
2SO3(g),并达到平衡,在此过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
A.等于p% B.大于p% C.小于p% D.无法比较
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高二上学期期末考试化学试卷(A卷)(解析版) 题型:选择题
在一定温度下的恒容密闭容器中,能说明反应X2(g)+ Y2(g) 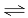 2XY(g) 已达到平衡的是( )
2XY(g) 已达到平衡的是( )
A.容器中的总压不随时间变化
B.容器中的气体平均相对分子质量不随时间变化
C.容器中的混合气体的密度不随时间变化
D.容器中的各种气体的质量分数不随时间变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com