
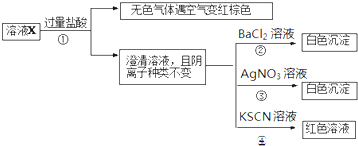
| A、无色气体可能是NO和CO2的混合物 |
| B、由步骤③可以确定原溶液中含有Cl- |
| C、溶液X中所含离子种类共有4种 |
| D、另取l00mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为1.2g |


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:
| A、在标准状况下,11.2L 氦气含有NA个氦原子 |
| B、25℃,1.01×105Pa,64gSO2中含有的原子数为3NA |
| C、11.2L CO含有的分子数为0.5NA |
| D、1mol氧分子含有的电子数与1mol氮气含有的电子数之比为16:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 装置 |  |  |  |  |
| 部分实 验现象 | a极质量减小,b极质量增大 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
| A、a>b>c>d |
| B、b>c>d>a |
| C、d>a>b>c |
| D、a>b>d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、σ键能单独形成,而π键一定不能单独形成 |
| B、σ键可以绕键轴旋转,π键一定不能绕键轴旋转 |
| C、HCl 分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的 |
| D、气体单质中一定存在σ键,可能存在π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:| 一定条件 |
| H2 |
| Ni,△ |
| 浓H2So4 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不可将温度计当搅拌棒使用,也不可靠在容器内壁上 |
| B、搅拌时,环形玻璃搅拌棒应上下移动 |
| C、测量反应混合液的温度时要随时读取温度,记录下最高温度 |
| D、为了使反应完全,必须保证酸和碱恰好完全反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com